-
在含有Fe3+、Fe2+、AL3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,反应完全后,离子数目几乎没有变化的是( )
A. Fe3+ B. Fe2+ C. AL3+ D. NH4+
难度: 简单查看答案及解析
-
下列气体中,对大气无污染的是
A. NO2 B. SO2 C. NO D. CO2
难度: 简单查看答案及解析
-
下列单质最难与氢气化合的是
A. S B. O2 C. Cl2 D. F2
难度: 简单查看答案及解析
-
下列有关化学药品说明正确的是
A. 砒霜(As2O3):剧毒品
 B. 白磷:爆炸品
B. 白磷:爆炸品C. 硅酸钠溶液:用带玻璃塞的试剂瓶储存 D. Fe(OH)3胶体:透明无色液体
难度: 中等查看答案及解析
-
下列中草药煎制步骤中,属于过滤操作的是( )
A.冷水浸泡
B.加热煎制
C.箅渣取液
D.灌装保存
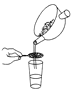
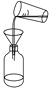
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
是重要的核工业原料,下列关于
的说法正确的是
A. 原子核中含有92个中子
B. 原子核外有143个电子
C. 铀元素的相对原子质量为235
D. 是铀元素的一种同位素
难度: 中等查看答案及解析
-
生活中下列物质起还原作用的是
A. 铁粉作脱氧剂 B. 硅胶作干燥剂 C. 二氧化硫作漂白剂 D. 活性炭作吸附剂
难度: 简单查看答案及解析
-
下列有关NaHCO3的应用错误的是
A. 用作抗酸药 B. 用作净水剂 C. 用作发酵粉 D. 用作灭火剂
难度: 中等查看答案及解析
-
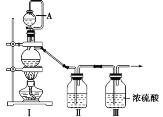
浓硫酸跟锌充分反应,生成物中一定没有的是
A. SO2 B. SO3 C. H2 D. ZnSO4
难度: 中等查看答案及解析
-
在工业上,下列金属的冶炼方法错误的是
A. 加热法冶炼汞 B. 电解法冶炼铝 C. 电解法冶炼铜 D. 热还原法冶炼铁
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离产生的c(H+)=1×10—13mol/L,在该溶液中一定能大量存在的离子是
A. HCO3— B. NH4+ C. Mg2+ D. NO3—
难度: 中等查看答案及解析
-
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是
①Ca(HCO3)2 ②Al2O3 ③Al(OH)3 ④NaAlO2 ⑤(NH4)2S ⑥Al
A. 只有②③ B. 只有②③⑥ C. ①②③⑤⑥ D. 全部
难度: 中等查看答案及解析
-
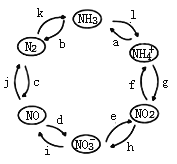
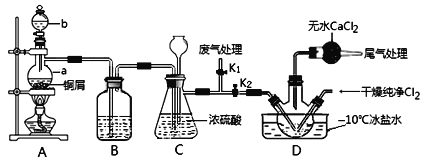
氯气是一种重要的化工原料。工业上利用反应3Cl2 + 8NH3 = N2 + 6NH4Cl检查输送氯气的管道是否漏气。下列说法错误的是
A. 该反应属于置换反应 B. 该反应利用了Cl2的强氧化性
C. 生成1 mol N2时有6 mol电子转移 D. 若管道漏气遇氨就会产生白雾
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 2g D2O中含有的质子数、中子数、电子数均为NA
B. 将l00mL 0.1mol•L—1FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数为0.01NA
C. 1mol NaOH晶体中,含有的离子总数为3NA
D. 100mL 0.1mol•L—1 的氨水中,含NH3·H2O的数目为0.01NA
难度: 中等查看答案及解析
-
下列实验不能达到目的的是
A. 向Na2SiO3溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解反应
B. 向HClO溶液中通入SO2生成H2SO4,证明HClO的酸性比H2SO4强
C. 铝箔在酒精灯火焰上加热,铝箔熔化但不滴落,证明氧化铝熔点高于铝
D. 将氯水滴到蓝色石蕊试纸上试纸先变红后褪色,证明氯水有酸性和漂白性
难度: 中等查看答案及解析
-
10℃时加热NaHCO3溶液,测得溶液pH发生如下变化:
温度(℃)
10
20
30
加热煮沸后冷却到50℃
pH
8.3
8.4
8.5
8.8
下列判断正确的是
A. 50℃时,c(OH—)=1×10—5.2mol/L B. 30℃时,c(Na+)=c(HCO3—) +2c(CO32—)
C. 升高温度,c(Na+)/c(HCO3—)增大 D. 将NaHCO3溶液蒸干,得到NaOH固体
难度: 困难查看答案及解析
-
已知Ksp(CaCO3)=3.36×10—9,Ksp(CaF2)=3.45×10—11。下列关于CaCO3和CaF2两悬浊液说法错误的是
A. CaCO3悬浊液中c(Ca2+)较小
B. 分别滴加稀硫酸,溶度积常数均增大
C. 分别加入0.1mol/L的CaCl2溶液,c(CO32—)和 c(F—)均减小
D. CaF2更容易转化成CaCO3
难度: 困难查看答案及解析
-
下列有关说法正确的是
A. 在Na2S溶液中加入少量的Na2S固体,Na2S的水解程度减小
B. Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)室温下不能自发进行,说明该反应的ΔH>0
C. 用碱式滴定管量取20.00mL酸性高锰酸钾溶液
D. 室温下,pH分别为2和4的盐酸等体积混合后,溶液pH=3
难度: 中等查看答案及解析
-
25℃时,向盛有50 mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,实验测得加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如下图所示。下列叙述正确的是
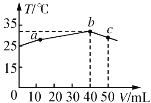
A. HA溶液的物质的量浓度为0.01 mol·L-1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离常数K约为1.25×10-2
难度: 困难查看答案及解析
-
I2在KI溶液中存在下列平衡:I2(aq)+I—(aq)
I3—(aq)。某I2、KI混合溶液中,I3—的物质的量浓度c(I3—)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法都正确的是
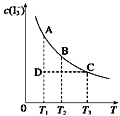
①反应I2(aq) +I—(aq)
I3—(aq)的
H>0
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
③若反应进行到状态D时,一定有v正>v逆
④状态A与状态B相比,状态A的c(I2)大
⑤保持温度不变,在该混合液中加水,c(I3—)/c(I2)将变大
A. 只有①② B. 只有②③ C. ②③④ D. ②③⑤
难度: 困难查看答案及解析