-
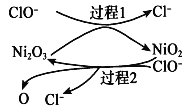
短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确的是
A. X的简单氢化物的热稳定性比W强
B. Y的简单离子与X的具有相同的电子层结构
C. Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D. Z与X属于同一主族,与Y属于同一周期
难度: 中等查看答案及解析
-
水是生命之源,下列有关说法中正确的是( )
A. 双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染
B. 氯水放置数天后,漂白性和酸性均减弱
C. 氨水能导电,说明氨气是电解质
D. 王水是浓盐酸和浓硝酸按体积比3:1配成的混合物,可以溶解Au、Pt
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. “臭氧空洞”、“光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
B. 工业海水制取镁流程:海水
Mg(OH)2→MgCl2
Mg
C. 推广使用乙醇汽油代替汽油目的是为了减少温室气体的排放
D. 工业生产玻璃、水泥都用石灰石做原料
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 标准状况下,2.24 L Cl2与过量水反应,转移的电子总数为0.1 NA
B. 一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA
C. 常温下,1 L 0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2NA
D. 标准状况下,22.4 L SO3中含硫原子数为NA
难度: 中等查看答案及解析
-
下列物质的俗称、成分及用途对应正确的是( )
A
B
C
D
俗称
漂粉精
小苏打
钡餐
铁红
成分
NaClO
Na2CO3
BaCO3
Fe2O3
用途
消毒剂
发酵粉
X光片
涂料
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 凡是单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
B. 不存在两种质子数和电子数完全相同的阳离子和阴离子
C. 同一短周期元素的离子半径从左到右逐渐减小
D. 元素非金属性越强,对应氢化物的酸性越强
难度: 中等查看答案及解析
-
下列残留物的洗涤方法错误的是( )
残留物
洗涤剂
A
容器里附有的油污
热的纯碱溶液
B
容器壁上附着的硫
酒精
C
试管上的银镜
稀HNO3
D
AgCl
氨水
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
硒(Se)与硫在元素周期表中位于同一主族。下列说法不正确的是( )
A. 原子半径:Se > S B. 沸点:H2S > H2Se
C. 稳定性:H2S > H2Se D. 酸性:H2SO4 > H2SeO4
难度: 简单查看答案及解析
-
下列各组离子可能大量共存的是( )
A. pH=0的溶液中:Na+、K+、ClO-、AlO2-
B. 能与金属铝反应放出氢气的溶液中: K+、NO3-、Cl-、NH4+
C. 常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO32-
D. 无色透明溶液:K+、NO3-、Fe3+、SO42-
难度: 中等查看答案及解析
-
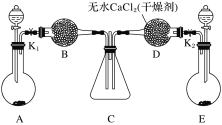
下图是实验室制取气体装置,其中发生装置相同(省去了铁架台和锥形瓶中的药品),干燥和收集装置有二套,分别用图一和图二。下列选项中不正确的是( )
A
锌和稀盐酸
选用图1
B
碳化钙和饱和食盐水
选用图1
C
铜和浓硫酸
选用图2
D
过氧化钠和水
选用图2
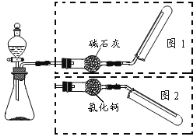
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列各组物质中,不能按
(“→”表示一步完成)的关系相互转化的是( )
选项
a
b
c
A
Fe
FeCl2
FeCl3
B
Si
SiO2
SiF4
C
HNO3
NO
NO2
D
Al
Al2O3
Al(OH)3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素x,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中正确的是( )
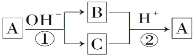
A. 反应①和②一定为氧化还原反应
B. 反应①和②互为可逆反应
C. X元素可能是金属,也可能是非金属
D. X元素可能为铝
难度: 困难查看答案及解析
-
下列四组物质反应,其中与其它三组有本质不同的是( )
A. Na2O2+ H2O B. F2+ H2O
C. Cl2+ H2O D. NO2 + H2O
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 在铜和浓硫酸反应后的试管中加水,以观察溶液颜色
B. 燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
C. 用氯水进行水处理,夏季比冬季的效果好
D. 稀硝酸与金属反应生成金属硝酸盐,当还原产物只有NO时,参加反应的金属在反应后无论化合价怎样,参加反应的硝酸与还原产物物质的量之比始终为4∶1
难度: 中等查看答案及解析
-
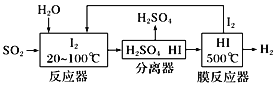
工业上常用氨碱法制取碳酸钠,却不能用氨碱法制碳酸钾,这是因为在溶液中( )
A. KHCO3溶解度较大 B. KHCO3溶解度较小 C. K2CO3溶解度较大 D. K2CO3溶解度较小
难度: 简单查看答案及解析
-
用如图表示的一些物质或概念间的从属关系中不正确的是:

X
Y
Z
例
氧化物
化合物
纯净物
A
苯的同系物
芳香烃
芳香族化合物
B
胶体
分散系
混合物
C
电解质
离子化合物
化合物
D
碱性氧化物
金属氧化物
氧化物
难度: 简单查看答案及解析
-
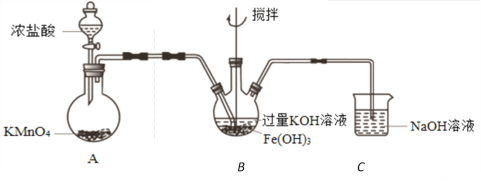
为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )
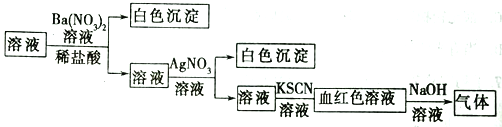
A. 原溶液中一定含有SO42- B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl- D. 原溶液中一定含有Fe3+
难度: 中等查看答案及解析
-
科学的假设与猜想是科学探究的先导和价值所在。在下列假设(猜想)引导下的探究肯定没有意义的选项是( )
A. 探究SO2和Na2O2反应可能有Na2SO4生成
B. 探究Mg(OH) 2溶解于NH4Cl是NH4+水解呈酸性所致,还是NH4+与OH-结合所致
C. 探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是Cu(OH)2
D. 探究向滴有酚酞试液的NaOH溶液中通以Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致
难度: 中等查看答案及解析
-
四种短周期主族元素在周期表中的位置如图,则下列说法错误的是( )
A. 若Y的最简单氢化物的沸点比M的低,则X单质可与强碱溶液反应
B. 简单阴离子半径:M>Z>Y
C. 最高价氧化物对应水化物的酸性:Z>M
D. 若Y的氢化物的水溶液呈碱性,则X的氧化物不与任何酸反应
难度: 中等查看答案及解析
-
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于( )
A. 8.64 B. 9.20 C. 9.00 D. 9.44
难度: 中等查看答案及解析