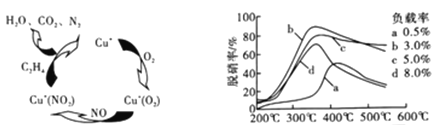
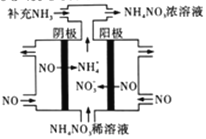
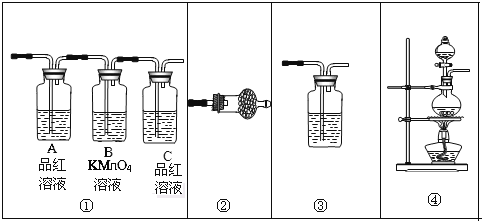
-
下列有关金属腐蚀与防护的说法正确的是( )
A. 金属的化学腐蚀比电化学腐蚀更普遍
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 海轮外壳焊接锌块是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A. 饱和氯水中:Cl-、
、Na+、
B. c(H+)=1.0×10-13mol·L-1溶液中:K+、
、Br-
C. Na2S溶液中:
、K+、Cl-、Cu2+
D. pH=12的溶液中:
、I-、Na+、Al3+
难度: 中等查看答案及解析
-
一定条件下的可逆反应:2SO2(g)+O2(g)
2SO3(g),若改变下列条件,可提高反应物中的活化分子百分数的是( )
A. 升高温度 B. 降低温度 C. 增大压强 D. 增大反应物浓度
难度: 中等查看答案及解析
-
下列有关物质的表达式正确的是
A. 乙炔的比例模型示意图:
B. 乙烯的结构简式:CH2CH2
C. 甲基的电子式:
D. 1,3-丁二烯的分子式:C4H8
难度: 中等查看答案及解析
-
某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s) ΔH>0,一段时间后,达到化学平衡状态.下列叙述正确的是
A. 通入稀有气体,平衡向正反应方向移动
B. 加入少量W,逆反应速率增大
C. 升高温度,正反应速率增大,逆反应速率减小
D. 降低温度,平衡向逆反应方向移动
难度: 中等查看答案及解析
-
一定条件下,可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是
A. C1∶C2=1∶3 B. 平衡时,Y和Z的生成速率之比为3∶2
C. X、Y的转化率不相等 D. C1的取值范围为0<C1<0.14 mol·L-1
难度: 简单查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
难度: 中等查看答案及解析