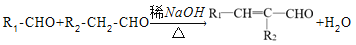-
短周期主族元素a、b、c、d的原子序数依次增大,a原子的最外层电子数是其质子数的2/3,b原子的核电荷数等于d原子的最外层电子数,元素c的最高正化合价为+2价。下列说法正确的是
A. 单质的佛点:a<b B. 简单离子的半径:d>c
C. b、d的氧化物对应的水化物均为强酸 D. b、c可形成离子化合物b2c2。
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列叙述正确的是( )
A. 煤的干馏和石油的分馏均属化学变化
B. BaSO4在医学上用做钡餐,Ba2+对人体无毒
C. 14C可用于文物的年代鉴定,14C与12C互为同素异形体
D. 葡萄糖注射液不能产生丁达尔现象,不属于胶体
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1L 0.1mol·L-1NaHSO3溶液中含有H+的数目为NA个
B. 常温常压下,等质量的CO2和N2O的气体体积相等
C. 60g组成为C2H4O2的有机物含C-H键数目一定为3NA个
D. 25℃时,pH=1的H3PO4溶液中含有的H+数目为0.1NA
难度: 中等查看答案及解析
-
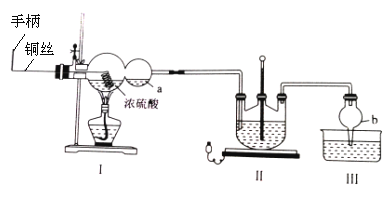
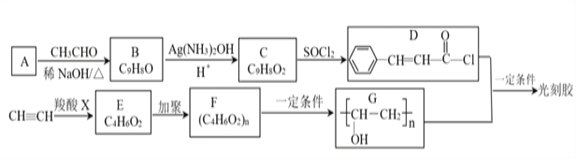
下列有关各实验的叙述中正确的是

A. ①澄清石灰水变浑浊,证明蔗糖与浓硫酸反应生成了CO2
B. ②进行H2、NH3、CO2、Cl2、NO、NO2等气体的收集
C. ③当X选用苯时可进行NH3或HCl的吸收,并防止倒吸
D. ④可用于NH3的干燥,收集并吸收多余NH3
难度: 困难查看答案及解析
-
下列关于有机物的叙述正确的是( )
A. 乙烯、聚氯乙烯和苯分子中均含有碳碳双键
B. 苯、油脂均不能使酸性KMnO4溶液褪色
C. 氯苯分子中所有原子都处于同一平面
D.
、
、
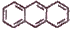 互为同系物
互为同系物难度: 简单查看答案及解析
-
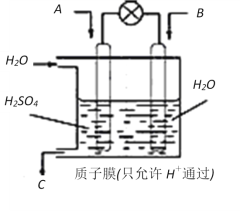
如图为镁--次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是
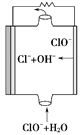
A. 该燃料电池中镁为负极,发生还原反应
B. 电池的总反应式为Mg+ClO-+H2O===Mg(OH)2↓+Cl-
C. 放电过程中OH-移向负极
D. 酸性电解质的镁--过氧化氢燃料电池正极反应为:H2O2+2H++2e-===2H2O
难度: 中等查看答案及解析
-
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如下图所示。下列有关叙述正确的是

A. b点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B. 随pH增大,c(CO32-)/c(HCO3-)数值先减小后增大
C. 25℃时,碳酸的第一步电离常数Ka1=10-6
D. 溶液呈中性时:c(HCO3- )>c(Cl-)>c(CO32-)
难度: 困难查看答案及解析