-
将纯水加热至较高温度,下列叙述正确的是
A、水的离子积变大,pH变小,呈酸性
B、水的离子积不变,pH不变,呈中性
C、水的离子积变小,pH变大,呈碱性
D、水的离子积变大,pH变小,呈中性
难度: 简单查看答案及解析
-
在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是( )
A. 反应开始时,正反应速率最大,逆反应速率为零
B. 随着反应的进行,正反应速率逐渐减小,最后为零
C. 随着反应的进行,逆反应速率逐渐增大,最后不变
D. 随着反应的进行,正反应速率逐渐减小,最后不变
难度: 中等查看答案及解析
-
已知反应物的总能量高于产物的总能量,则反应是( )
A. 放热反应 B. 吸热反应 C. 有催化剂作用 D. 无法判断
难度: 中等查看答案及解析
-
把a、b、c、d四块金属浸入稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时a溶解;c、d相连时c为负极;a、c相连时,c极上产生大量气泡;b、d相连时,b为正极,则四种金属活动性顺序由强到弱为( )
A. a>b>c>d B. a>c>d>b C. c>a>b>d D. b>d>c>a
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 体系有序性越高,熵值就越低 B. 自发过程可以导致体系的熵增大
C. 吸热反应不可以自发进行 D. 同种物质气态时熵值最大
难度: 简单查看答案及解析
-
下列反应中,在原理上可以设计成原电池的是( )
A. Ba(OH)2·8H2O与NH4Cl的反应 B. 氧化铝与硫酸的反应
C. 甲烷与氧气的反应 D. 石灰石的分解反应
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是( )
A. C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1367.0kl
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3kl/mol
C. S(s)+O2(g)=SO2(g)△H=-296.8kl/mol
D. 2NO2=O2+2NO △H=+116.2kl/mol
难度: 简单查看答案及解析
-
下列说法正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液的强
B. 氨气是弱电解质,铜是强电解质
C. 氯化钠是强电解质,醋酸是弱电解质
D. 硫酸钠是强电解质,硫酸钡是弱电解质
难度: 简单查看答案及解析
-
100 mL浓度为2 mol·L-1的盐酸跟锌片反应,以下操作对速率无影响的是( )
A. 升温 B. 加入5 mol·L-1的盐酸
C. 加入适量蒸馏水 D. 加入锌片
难度: 简单查看答案及解析
-
可逆反应2SO2(g)+O2(g)
2SO3(g)达平衡后,通入18O2,再次达到平衡时,18O存在于( )
A. SO3、O2 B. SO2、SO3 C. SO2、O2、SO3 D. SO2、O2
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. HCl溶液中无OH- B. NaOH溶液中无H+
C. KCl溶液中既无H+也无OH- D. 常温下,任何物质的水溶液中都有H+和OH-,且KW=1×10-14
难度: 简单查看答案及解析
-
如图所示,a曲线表示一定条件下可逆反应:X(g)+Y(g)
2Z(g)+W(g) △H<0 的反应过程中X的转化率和时间的关系,若使a曲线变为b曲线,可采取的措施是
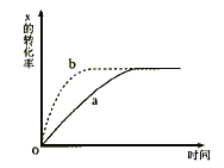
A. 加入催化剂 B. 增大Y的浓度
C. 降低温度 D. 增大体系压强
难度: 中等查看答案及解析
-
在0.1 mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡下列叙述正确的是
A. 加入水时,平衡逆向移动
B. 加入少量NaOH固体,平衡正向移动
C. 加入少量0.1 mol/L 盐酸,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡正向移动
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Mg2+、Cl—、SO42—
B. 室温下,pH=1的盐酸中:Na+、Fe3+、NO3—、SO42—
C. 含有Ca2+的溶液中:Na+、K+、CO32—、Cl—
D. 由水电离产生的c(H+)=1×10—3溶液中:Na+、K+、Cl—、SiO32—
难度: 中等查看答案及解析
-
下列体系加压后,对化学反应速率没有影响的是 ( )
A. 2SO2+O2
2SO3 B. CO+H2O(g)
CO2+H2
C. CO2+H2O
H2CO3 D. OH-+H+=H2O
难度: 简单查看答案及解析
-
用pH试纸测定溶液pH的正确操作是( )
A. 将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
B. 将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照
C. 将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照
D. 将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照
难度: 中等查看答案及解析
-
下列微粒中不能破坏水的电离平衡的是( )
A. H+ B. OH- C. S2- D. Na+
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. v(C)=0.04mol/(L·s) B. v(B)=0.06mol/(L·s)
C. v(A)=0.03mol/(L·s) D. v(D)=0.01mol/(L·s)
难度: 中等查看答案及解析
-
下列说法中,可以证明反应 N2+3H2
2NH3 已达平衡状态的是( )
A. 一个N≡N键断裂的同时,有三个H-H键形成
B. 一个N≡N键断裂的同时,有三个H-H键断裂
C. 一个N≡N键断裂的同时,有两个N-H键断裂
D. 一个N≡N键断裂的同时,有六个N-H键形成
难度: 中等查看答案及解析
-
在可逆反应中,平衡常数与反应进行的限度关系正确的是( )
A. K越大,反应程度越大 B. K越大,反应程度越小
C. K的大小与反应程度无关 D. 升高温度,K增大
难度: 中等查看答案及解析
