-
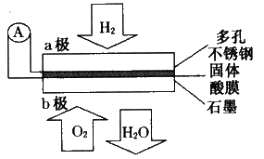
(2014•长宁区一模)①②③④甲种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A. ①③②④ B. ①③④② C. ③④②① D. ③①②④
难度: 中等查看答案及解析
-
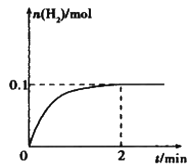
1913年德国化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列是哈伯法的流程图,其中为提高原料转化率而采取的措施是( )。
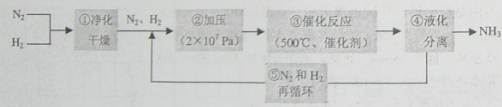
A. ①②③ B. ②④⑤ C. ①③⑤ D. ②③④
难度: 中等查看答案及解析
-
下列事实中,不能应用化学平衡移动原理来解释的是
①可用浓氨水和NaOH固体快速制氨气 ②700K左右比室温更有利于合成氨反应
③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的KW增大
⑤对于反应2HI(g)
H2(g)+I2(g)达平衡后,缩小容器体积可使体系颜色变深
A. ①②③ B. ②④⑤ C. ②⑤ D. ④⑤
难度: 简单查看答案及解析
-
一定条件下,将A、B、C三种物质各1 mol通入一个密闭容器中发生反应:2A+B
2C,达到平衡时,B的物质的量可能是( )
A. 1.5mol B. 1 mol C. 0.5 mol D. 0 mol
难度: 中等查看答案及解析
-
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是

A. 该反应为放热反应
B. 催化剂能改变该反应的焓变
C. 正、逆反应的活化能之差等于焓变
D. 逆反应的活化能大于正反应的活化能
难度: 简单查看答案及解析
-
电解CuSO4溶液时,若必须达到以下三点要求:①阳极质量减少,②阴极质量增加,③电解液中c(Cu2+)不变。则可选用的电极是
A.含Zn、Ag的铜合金作阳极,纯铜作阴极
B.用纯铁作阳极,纯铜作阴极
C.用石墨作阳极,惰性电极(Pt)作阴极
D.用纯铜作阳极,含Zn、Ag的铜合金作阴极
难度: 中等查看答案及解析
-
在25℃时,某无色溶液中由水电离出的c(H+)、c(OH-)满足c(H+)×c(OH-)=1×10-24mol2 •L-2,下列各组离子在该溶液中一定大量共存的是( )
A. Al3+ Na+ NO3- CO32- B. Fe2+ K+ NO3- SO42-
C. Na+ K+ [Al(OH)4]- Cl- D. Ba2+ K+ Cl- NO3-
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的
C. 应用盖斯定律可计算某些难以直接测量的反应焓变
D. 1g碳与适量水蒸气反应生成 CO和H2,吸收10.94kJ热量,则热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ/mol
难度: 中等查看答案及解析
-
下列说法正确的是
A. 25℃时,同物质的量浓度的酸、碱溶液中,水的电离程度相同
B. 25℃时,水在同pH的硫酸溶液和醋酸溶液中的电离程度不同
C. 某温度下,某溶液中[H+]=1.0×10-7 mol/L,则该溶液一定呈中性
D. 常温下,某溶液由水电离出的[OH-]=1×10-13 mol/L,则该溶液可能呈酸性,也可能呈碱性
难度: 中等查看答案及解析
-
结合图判断,下列叙述正确的是
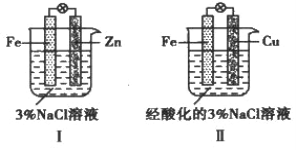
A. I和II中正极均被保护
B. I和II中负极反应均是Fe-2e-===Fe2+
C. I和II中正极反应均是O2+2H2O+4e-===4OH-
D. I和II中电池反应均为Fe+2H+===Fe2++H2↑
难度: 简单查看答案及解析
-
某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是( )

A. 若T2>T1,则正反应一定是放热反应
B. 达到平衡时A2的转化率大小为:b>a>c
C. 若T2>T1,达到平衡时b、d点的反应速率为vd> vb
D. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小为:c>b>a
难度: 中等查看答案及解析
-
某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. (a+b)>(c+d)
C. Z的体积分数变小 D. X的转化率变大
难度: 困难查看答案及解析
-
已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是
①生成物的体积分数一定增大 ②生成物的产量一定增加 ③反应物的转化率一定增大 ④反应物浓度一定降低 ⑤逆反应速率一定降低 ⑥使用合适的催化剂
A. ② B. ①②③ C. ②③④ D. ④⑥
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 某温度下,蒸馏水中的[H+]=1.0×10—6mol·L—1,则该温度一定高于25℃
B. 25℃时,pH=13的氢氧化钡溶液中,由水电离出来的[H+]=1.0×10—13mol·L—1,此时由水电离出来的[OH—]
[H+]
C. 25℃时,水中加入氢氧化钠固体,水的电离平衡逆向移动,水的离子积减小
D. 25℃时,0.1 mol·L—1的盐酸与0.1mol·L—1的NaOH溶液中,水的电离程度不同
难度: 中等查看答案及解析
-
可逆反应aA(s)+bB(g)
cC(g)+dD(g);△H=QkJ/mol,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:则以下正确的是
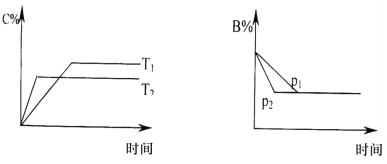
A. T1>T2,Q>0
B. T2>T1,Q>0
C. P1<P2,a+b=c+d
D. P1<P2,b=c+d
难度: 中等查看答案及解析
-
在一定条件下,对于反应:mA(g)+nB(g)⇌cC(g)+dD(g),C物质的质量分数(C%)与温度、压强的关系如图,下列判断正确的是( )

A. △H<0△S>0 B. △H>0△S<0
C. △H>0△S>0 D. △H<0△S<0
难度: 中等查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na
2Na2CO3+C。下列说法错误的是( )。
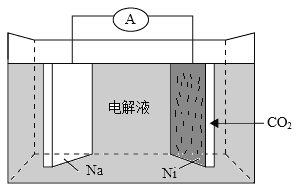
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e-=2CO32-+C
D. 充电时,正极反应为:Na++e-=Na
难度: 中等查看答案及解析
-
一定温度下,在密闭容器中发生如下反应:N2O4(g)
2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
A. 若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B. 若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C. 若体积不变,向容器中再加入一定量的N2O4,平衡向逆反应方向移动,再次平衡时N2O4的转化率将降低
D. 若体积不变,升高温度,再次平衡时体系颜色加深
难度: 中等查看答案及解析
-
下列说法中有明显错误的是( )
A. 加入适宜的催化剂,使分子能量增加,从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率
B. 活化分子之间发生的碰撞不一定为有效碰撞
C. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D. 对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
难度: 中等查看答案及解析
-
在一定温度下发生反应:I2(g)+H2(g)
2HI(g); △H<0并达平衡。HI的体积分数随时间变化如下图曲线(II)所示,若改变反应条件,在甲条件下HI的体积分数的变化如曲线(I)所示。在乙条件下HI的体积分数的变化如曲线(III)所示。则甲条件、乙条件分别是

①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当的催化剂
A. ①⑤, ③ B. ②⑤, ④ C. ③⑤, ② D. ③⑤, ④
难度: 中等查看答案及解析
-
放热反应CO(g)+H2O(g)
CO2(g)+H2(g)在温度t1时达到平衡,平衡时C1(CO)=C1(H2O)=1.0 mol/L,其平衡常数为K1。升高反应体系的温度至t2时,反应物的平衡浓度分别为C2(CO)和C2(H2O),平衡常数为K2,则
A. K1和K2的单位均为mol/L B. K1 < K2
C. C2(CO) = C2(H2O) D. C1(CO) > C2(CO)
难度: 中等查看答案及解析
-
如下图所示,按图甲装置进行实验,若图乙的x轴表示流入电极的电子的量,则y轴不可能表示的是 ( )
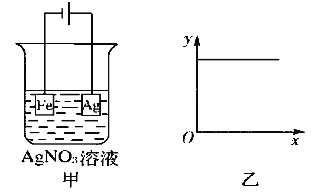
A. c(Ag+) B. c(NO)
C. 溶液氢离子浓度 D. 阴极质量
难度: 中等查看答案及解析
-
一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1
容器2
容器3
反应温度T/K
700
700
800
反应物投入量
2molSO2、1molO2
4molSO3
2molSO2、1molO2
平衡v正(SO2)/mol·L-1·s-1
v1
v2
v3
平衡c(SO3)/mol·L-1
c1
c2
c3
平衡体系总压强p/Pa
p1
p2
p3
物质的平衡转化率a
α1 (SO2)
α2 (SO3)
α3 (SO2)
平衡常数K
K1
K2
K3
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) <α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
难度: 中等查看答案及解析
-
将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:

① b<f ② 915℃、2.0 MPa时E的转化率为60% ③ 增大压强平衡左移 ④ K(1 000℃)>K(810℃) 上述①~④中正确的有( )
A. 4个 B. 3个 C. 2个 D. 1个
难度: 困难查看答案及解析