-
下列有关能量的说法不正确的是
A. 化学能可以转变成为热能、电能等
B. 应用盖斯定律,可计算某些难以用实验直接测量的反应焓变
C. 化学反应中的能量变化主要是由化学键的变化引起的
D. 酸碱中和反应放出的能量可设计为原电池转化为电能
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示
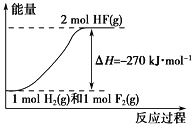
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol−1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol−1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol−1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol−1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol−1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1
难度: 中等查看答案及解析
-
已知下列热化学方程式:
(1)CH3COOH (l)+2O2 (g) == 2CO2 (g)+2H2O (l) ΔH1=-870.3 kJ·mol-1
(2)C (s)+ O2 (g) == CO2 (g) △H2=-393.5 kJ•mol-1
(3)H2(g) +
O2(g) == H2O (l) △H3=-285.8kJ·mol-1
则反应2C (s)+2H2 (g) +O2 (g) == CH3COOH (l)的△H为
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
难度: 中等查看答案及解析
-
已知25℃、101kPa条件下:4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = -2800 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = -3100kJ/mol。
由此得出的结论正确的是
A. O2比O3稳定,由O2变O3 为放热反应
B. O3比O2稳定,由O2变O3 为吸热反应
C. 等质量的O2与O3分别与足量的可燃物充分反应,后者释放的能量更多
D. 将O2转化为O3的过程是物理变化
难度: 困难查看答案及解析
-
如图所示的装置用石墨电极电解饱和食盐水(两极均滴酚酞),以下说法正确的是
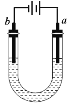
A. a电极附近溶液酸性减弱
B. a电极上发生还原反应
C. b电极附近酚酞变红
D. b电极上有黄绿色气体产生
难度: 中等查看答案及解析
-
下列关于下图所示装置的叙述,不正确的是( )
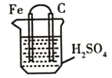
A.该装置是利用氧化还原反应将化学能转化成电能
B.铁片质量逐渐减少,碳棒上有气泡产生
C.电流由铁片经导线沿外电路流向碳棒
D.该装置总的化学反应为Fe+H2SO4=FeSO4+H2↑
难度: 中等查看答案及解析
-
下列事实不用原电池原理解释的是( )
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铁被钝化处理后不易腐蚀
C. 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快
D. 烧过菜的铁锅加入清水放置,出现红棕色的锈斑
难度: 简单查看答案及解析
-
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
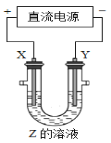
A. 氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
B. 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C. 电镀工业中,X是待镀金属,Y是镀层金属
D. 外加电流的阴极保护法中,X是待保护金属
难度: 中等查看答案及解析
-
右图所示是一种新近开发的固体氧化物燃料电池。它以掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体为固体电解质,在熔融状态下传导氧离子 (O2-),其中多孔电极a、b均不参与电极反应。
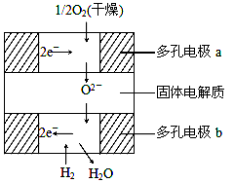
下列判断不正确的是( )
A.采用多孔电极的目的是易于吸附气体
B.有H2放电的b极为电池的负极
C.a极对应的电极反应为O2+2H2O+4e-=4OH-
D.b极对应的电极反应为2H2-4e-+2O2-=2H2O
难度: 中等查看答案及解析
-
Li﹣Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e﹣=Li2S+Fe。有关该电池的下列说法中,正确的是
A. 该电池的电池反应式为:2Li+FeS=Li2S+Fe
B. Li﹣Al在电池中作为负极材料,该材料中Li的化合价为+1价
C. 负极的电极反应式为Al﹣3e﹣=Al3+
D. 充电时,阴极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS
难度: 中等查看答案及解析
-
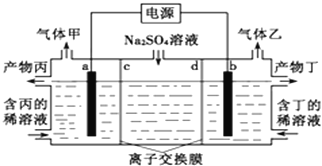
氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。该电池工作时的总反应为:NH3·BH3+ 3H2O2= NH4BO2+ 4H2O.下列说法正确的是

A. 负极附近溶液的PH增大
B. 正极的反应式为:H2O2+ 2H++2e-=2H2O
C. 电池工作时,BO2—通过质子交换膜向正极移动
D. 消耗3.lg氨硼烷,理论上转移0.2mol电子
难度: 困难查看答案及解析
-
用惰性电极电解下列溶液一段时间后再加入一定量的另一纯净物(方括号内),一定不能使溶液恢复的是
A. AgNO3 [Ag2O] B. CuCl2 [CuCl2]
C. NaOH [NaOH] D. CuSO4 [Cu(OH)2]
难度: 困难查看答案及解析
-
下列说法正确的是
A. 放热反应均是自发反应
B. H2、I2、HI平衡混合气加压后颜色变深,能用勒夏特列原理解释
C. 物质的量增加的反应,△S为正值
D. 2CO(g)=2C(s)+O2(g) 已知△H>0,则一定不能自发进行
难度: 中等查看答案及解析
-
只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是
A. 平衡移动,K值可能不变 B. 平衡移动,K值一定变化
C. K值不变,平衡可能移动 D. K值变化,平衡一定移动
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
难度: 中等查看答案及解析
-
一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
难度: 困难查看答案及解析
-
对反应N2O4(g)
2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
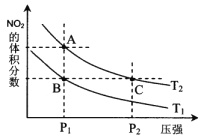
A. A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. B、C两点NO2的体积分数相同,所以平衡常数也相同
难度: 中等查看答案及解析