-
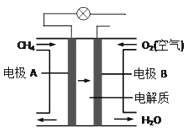
在电解水制取H2和O2时,为了增强溶液的导电性,常加入一些电解质.下列物质中最合适的是( )
A. NaCl B. CuC12 C. Na2SO4 D. AgNO3
难度: 中等查看答案及解析
-
下列有关滴定操作的顺序正确的是( )
①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管
④装标准溶液和待测液并调整液面(记录初读数)
⑤取一定体积的待测液于锥形瓶中 ⑥滴定操作
A. ①③②④⑤⑥ B. ①②③④⑤⑥ C. ②③①④⑤⑥ D. ④⑤①②③⑥
难度: 简单查看答案及解析
-
理论上下列反应不能设计成原电池反应的是( )
A. 2Fe3++Cu═2Fe2++Cu2+ B. Zn+2H+═Zn2++H2↑
C. 2H2+O2═2H2O D. H++OH﹣═H2O
难度: 中等查看答案及解析
-
下列有关问题,与盐的水解有关的是( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤
难度: 简单查看答案及解析
-
下列式子属于水解反应,且溶液呈酸性的是 ( )
A. HCO3- + H2O
H3O+ + CO32- B. Fe3+ + 3H2O
Fe(OH)3 + 3H+
C. HS- + H2O
H2S + OH- D. NH4+ + OH-
NH3↑+ H2O
难度: 简单查看答案及解析
-
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A. D>C>A>B B. D>A>B>C C. D>B>A>C D. B>A>D>C
难度: 中等查看答案及解析
-
现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A. ④>③>①=⑤>② B. ①=②>③>④>⑤ C. ②>①>③>④>⑤ D. ④>③>①>⑤>②
难度: 中等查看答案及解析
-
室温时,在由水电离出c(OH﹣)=1.0×10﹣12mol•L﹣1的溶液中,一定能大量共存的离子组是( )
A. K+、Na+、HCO3﹣、Cl﹣ B. K+、MnO4﹣、Br﹣、Cl﹣
C. Na+、Cl﹣、NO3﹣SO42﹣ D. Al3+、NH4+、Cl﹣、SO42﹣
难度: 困难查看答案及解析
-
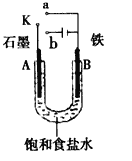
如图所示装置,可观察到电流计指针偏转,M棒变粗,N棒变细,下表所列M、N、P物质中,可以组合成该装置的是( )
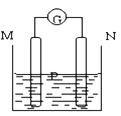
M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
关于下图所示装置的判断,叙述正确的是( )
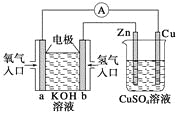
A. 左边的装置是电解池,右边的装置是原电池
B. 该装置中铜为正极,锌为负极
C. 当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D. 装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b
难度: 中等查看答案及解析
-
观察下列几个装置示意图,有关叙述正确的是( )
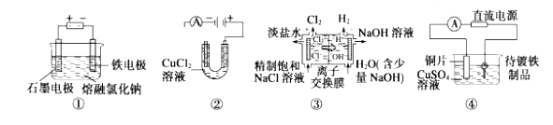
A. 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属
B. 装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝
C. 装置③中的离子交换膜允许阳离子、阴离子和小分子水通过
D. 装置④的待镀铁制品应与电源正极相连
难度: 困难查看答案及解析
-
用惰性电极电解CuSO4溶液一段时间后停止通电,若需向溶液中加入1molCu(OH)2才能使溶液恢复至电解前的状态,则电解过程中转移电子的物质的量为( )
A. 2mol B. 4mol C. 6mol D. 8mol
难度: 困难查看答案及解析
-
在一定条件下,Na2CO3溶液中存在CO32-+H2O
HCO3-+OH-平衡。下列说法不正确的是
A. 稀释溶液,[c(HCO3-)·c(OH-)]/c(CO32-)增大
B. 通入CO2,溶液pH减小
C. 升高温度,平衡常数增大
D. 加入NaOH固体,c(HCO3-)/c(CO32-)减小
难度: 简单查看答案及解析
-
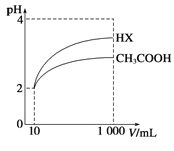
25℃条件下,向10 mL 0.1 mol·Lˉ1的HR溶液中逐滴滴入0.1 mol·Lˉ1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析错误的是( )
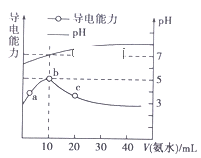
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液pH=7说明NH4R没有发生水解
C. c点溶液存在c(NH4+)>c(Rˉ)、c(OHˉ)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OHˉ)=KW=1.0×10ˉ14
难度: 困难查看答案及解析
-
在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )

A. t℃时,Y点和Z点时Ag2CrO4的Ksp相等
B. 饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C. t℃时,Ag2CrO4的Ksp为1×10-8
D. t℃时,将0.01mol·L-1AgNO3溶液滴入20mL0.01mol·L-1KCl和0.01mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
难度: 中等查看答案及解析
-
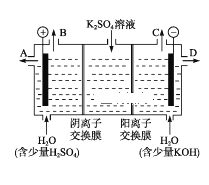
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )
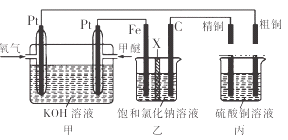
A. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B. 乙装置中铁电极为阴极,电极反应式为Fe﹣2e ﹣=Fe2+
C. 通入氧气的一极为正极,发生的电极反应为O2﹣4e ﹣+2H2O═4OH﹣
D. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
难度: 困难查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
某生产工艺中用惰性电极电解Na2CO3溶液获得NaHCO3和NaOH,其原理如图。下列有关说法正确的是( )
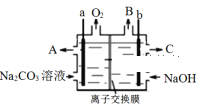
A. a 接外电源负极
B. B出口为H2,C出口为NaHCO3溶液
C. 阳极电极反应为4CO32-+2H2O-4e- = 4HCO3-+O2↑
D. 应选用阳离子交换膜,电解时Na+从右侧往左移动
难度: 困难查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A. Na2S 溶液中 c(OH﹣)=c(H+)+c(HS﹣)+2c(H2S)
B. Na2CO3溶液中:c(Na+)=2c(CO32﹣)+2c(HCO3﹣)
C. 室温下,pH=1的CH3COOH溶液和pH=13的NaOH溶液等体积混合,溶液中离子浓度的大小顺序:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D. pH=4的0.1mol•L﹣1NaHC2O4溶液中c(H C2O4﹣)>c(H+)>c(H2C2O4)>c(C2O42﹣)
难度: 困难查看答案及解析
-
三种难溶金属硫化物的溶度积常数(25℃):
化学式
FeS
CuS
MnS
溶度积
6.3×10﹣18
1.3×10﹣36
2.5×10﹣13
下列有关说法中正确的是( )
A. 25℃时,CuS的溶解度大于MnS的溶解度
B. 25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10﹣36 mol•L﹣1
C. 因为H2SO4是强酸,所以反应CuSO4+H2S=CuS↓+H2SO4不能发生
D. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂
难度: 中等查看答案及解析