-
偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力。下列叙述正确的是
A. 偏二甲肼的摩尔质量为60 g
B. 6.02×1023个偏二甲肼分子的质量约为60 g
C. 1 mol偏二甲肼的质量为60 g·mol-1
D. 6 g偏二甲肼含有NA个偏二甲肼分子
难度: 中等查看答案及解析
-
实验室里有4个药品橱,已经存放以下物品:
药品橱
甲橱
乙橱
丙橱
丁橱
药品
盐酸,硫酸
氢氧化钠,氢氧化钙
红磷,硫
铜,锌
实验室新购进一些碘,应该将这些碘放在( )
A. 甲橱 B. 乙橱 C. 丙橱 D. 丁橱
难度: 简单查看答案及解析
-
0.5 L AlCl3溶液中含Cl-个数为9.03×1022个,则AlCl3溶液的物质的量浓度为( )
A. 0.1 mol·L-1 B. 1 mol·L-1 C. 3 mol·L-1 D. 1.5 mol·L-1
难度: 中等查看答案及解析
-
如图所示的实验操作中正确的是( )
A.
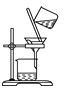 B.
B.  C.
C. D.

难度: 简单查看答案及解析
-
已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
难度: 简单查看答案及解析
-
下列关于萃取操作的说法正确的是( )
A. 从溴水中提取溴,可加入酒精作萃取剂
B. 萃取操作完成后,静置分液,上、下层液体均从下口放出
C. 用一种有机溶剂,提取水溶液中的某物质,静置分液后,“水层”应在上层
D. 萃取时,所加入的溶剂应与原溶剂互不相溶,且与原溶剂、溶质相互间不反应
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 摩尔是物质的量的单位,每摩尔物质含有6.02×1023个分子
B. 1 mol氧原子的质量为16
C. 0.5 mol He约含有6.02×1023个电子
D. 2H既可表示2个氢原子又可表示2 mol氢原子
难度: 中等查看答案及解析
-
下列物质中,与0.3 mol H2O含有相同氢原子数的物质是( )
A. 18.9 g HNO3 B. 3.612×1023个HCl分子
C. 0.1 mol H3PO4 D. 0.2NA个CH4分子
难度: 中等查看答案及解析
-
下列四幅图中,小白球代表的是氢原子,大灰球代表的是氦原子。最适合表示同温同压下,等质量的氢气与氦气的混合气体的图示是( )
A.
B.
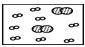 C.
C. D.
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 标准状况下,1.12 L H2和O2的混合气体含有的原子数为0.1NA
B. 标准状况下,22.4 L CCl4含有的分子数为NA
C. 通常状况下,NA个CO2分子占的体积为22.4 L
D. 0.5 mol的MgCl2固体中,含有离子的总数为NA
难度: 中等查看答案及解析
-
同温同压下,某容器充满N2重114 g,若充满He重102 g,现充满某气体重116 g,则该气体的相对分子质量为( )
A. 101 B. 17 C. 32 D. 10
难度: 中等查看答案及解析
-
将下列溶液加水稀释至100 mL,含Cl-浓度最大的是( )
A. 10 mL 0.1 mol·L-1的氯化铝溶液
B. 20 mL 0.1 mol·L-1的氯化钙溶液
C. 30 mL 0.2 mol·L-1的氯化钾溶液
D. 40 mL 0.25 mol·L-1的氯化钠溶液
难度: 简单查看答案及解析
-
下列制备胶体的方法中,可行的是( )
①将0.5 mol/L的BaCl2溶液和等体积2 mol/L的硫酸混合振荡 ②把几滴饱和的FeCl3溶液逐滴滴入20 mL沸水中,继续煮沸至溶液呈现红褐色 ③把1 mol/L NaOH溶液滴到1 mol/L FeCl3溶液中
A. ①② B. ①③ C. ② D. ①②③
难度: 中等查看答案及解析
-
淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A. 加入BaCl2溶液产生白色沉淀 B. 加入碘水不变蓝
C. 加入BaCl2溶液没有白色沉淀产生 D. 加入碘水变蓝
难度: 简单查看答案及解析
-
下列各反应的离子方程式中,正确的是( )
A. NaOH溶液与稀硫酸反应:2H++2OH-===2H2O
B. FeCl3溶液和Fe反应:Fe3++Fe===2Fe2+
C. 硫酸和氢氧化钡溶液反应:H++SO42—+Ba2++OH-===H2O+BaSO4↓
D. 氧化铜和稀盐酸反应:CuO+2H+===Cu2++H2O
难度: 中等查看答案及解析
-
在强酸性无色透明溶液中,下列各组离子能大量共存的是( )
A. Fe3+、K+、Cl-、NO3— B. Ag+、Na+、NO3—、Cl-
C. Zn2+、Al3+、SO42—、Cl- D. Ba2+、NH4+、Cl-、HCO3—
难度: 中等查看答案及解析


