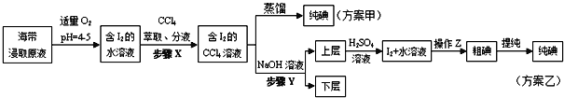
-
实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.1mol/L,下面四个选项中能达到此目的的是
A. Fe2+、Na+、NO3-、Cl- B. K+、Mg2+、CO32-、OH-
C. H+、K+、Cl-、CH3COO- D. Mg2+、NH4+、SO42-、NO3-
难度: 中等查看答案及解析
-
下列关于实验基本操作的叙述正确的是
A. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
B. 分液时,需收集上层液体,分层后直接从分液漏斗上口倒出上层液体
C. 将浓硫酸倒入盛水的量筒中稀释成稀硫酸
D. 使用容量瓶应先干燥,如果容量瓶中含有少量蒸馏水,会造成误差
难度: 中等查看答案及解析
-
以下实验装置一般不用于分离物质的是
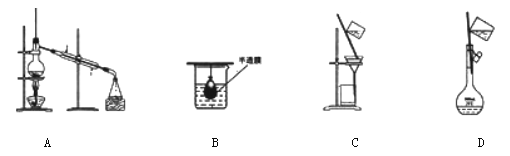
难度: 简单查看答案及解析
-
用NA表示阿伏伽德罗常数的值。下列判断正确的是
A. 84gNaHCO3溶于水之后可得到3NA个离子
B. 24g Mg变为Mg2+时失去的电子数目为NA
C. 1mol/L CaCl2溶液中含有的Cl-离子数目为2NA
D. 若lmolFeCl3在沸水中完全转化为氢氧化铁胶体,其中胶粒的数目小于NA个
难度: 中等查看答案及解析
-
下列物质中,不属于电解质的是
A. 烧碱 B. 盐酸 C. BaSO4 D. CuSO4·5H2O
难度: 简单查看答案及解析
-
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因可能是
A. 所用固体NaOH已潮解
B. 定容时仰视刻度
C. 用带游码的托盘天平称2.4g NaOH时,误把砝码放在了左边
D. 配制完毕,不小心溅出几滴溶液,为使溶液的浓度不减少,又在配好的溶液中加入少量的NaOH固体
难度: 中等查看答案及解析
-
把0.05molBa(OH)2固体加入到下列100mL液体中,溶液的导电能力明显变小的是
A. 水 B. 1mol/LMgCl2溶液 C. 1mol/L醋酸 D. 0.05mol/LCuSO4
难度: 中等查看答案及解析
-
在溶液中能大量共存,加入NaOH溶液后有沉淀产生,加入盐酸后有气体放出的是
A. Na+、Cu2+、Cl-、CO32- B. Fe3+、K+、SO42-、NO3–
C. Na+、Ba2+、Cl-、HCO3– D. Na+、SiO32-、OH-、NO3–
难度: 中等查看答案及解析
-
下列有关氢氧化铁胶体说法正确的是
A. 将外加直流电源通过该胶体,阴极处颜色变深,则说明该胶体带正电荷
B. 鉴别FeCl3溶液和Fe(OH)3胶体,可用丁达尔效应或观察能否导电两种方法
C. 采用过滤,可将Fe(OH)3胶体中的FeCl3杂质除去
D. 向Fe(OH)3胶体中加入NaCl固体,可引起胶体聚沉
难度: 中等查看答案及解析
-
为得到相同物质的量的氯离子,等物质的量浓度的NaCl、MgCl2、AlCl3的体积比为
A. 6∶3∶2 B. 3∶2∶1
C. 1∶1∶1 D. 1∶2∶3
难度: 中等查看答案及解析
-
下列反应的离子方程式错误的是
A. 等物质的量的Ba(OH)2与NH4HSO4在溶液中反应:Ba2++OH-+H++SO42- =BaSO4↓ +H2O
B. 氢氧化铁与足量的稀硝酸溶液反应:Fe(OH)3+3H+=Fe3++3H2O
C. 醋酸与纯碱溶液反应生成气体:2CH3COOH+CO32-=2CH3COO-+H2O+CO2↑
D. 向澄清石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3- =CaCO3↓+H2O
难度: 中等查看答案及解析
-
下列各组数据中,前者刚好是后者两倍的是
A. 2mol H2O的摩尔质量和1mol H2O的摩尔质量
B. 200mL1mol·L-1氯化钙溶液中c(Cl-)和100mL2mol·L-1氯化钾溶液中c(Cl-)
C. 称量16g硫酸铜配制250mL溶液的物质的量浓度和称量25g胆矾配制500mL溶液的物质的量浓度
D. 20%NaOH溶液的物质的量浓度和10%NaOH溶液的物质的量浓度
难度: 中等查看答案及解析
-
下列各选项中的反应①与反应②不能用同一离子方程式表示的是
序号
反应①
反应②
A
向AgNO3溶液中滴加稀盐酸
AgNO3溶液与食盐水混合
B
过量CO2通入NaOH 溶液中
过量CO2 通入澄清石灰水中
C
向烧碱溶液中滴加稀盐酸
向NaHSO4溶液中滴加KOH溶液
D
向Ba(OH)2溶液中滴加稀硫酸
向 Ba(OH)2溶液中滴加少量NaHSO4溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向体积相同的甲、乙两容器中分别通入一定量的CO2和N2O,下列说法不正确的是
A. 标准状况下,当两容器气体密度相同,则气体的物质的量相同
B. 向甲容器中通入一定的N2,使得两容器中氮原子数和氧原子数均相同,此时甲、乙两容器在同温下的压强之比为2:3
C. 将两气体混合,混合气体的平均摩尔质量为44g/mol
D. 同温同压下,两容器中气体质量相同
难度: 困难查看答案及解析
-
在同一条件下,体积相同的三个烧瓶中分别盛有NH3、HCl、NO2气体,并分别倒立在水槽中,充分反应后(已知:3NO2+H2O =2HNO3+NO,NO不溶于水),烧瓶内三种溶液的物质的量浓度之比为(设烧瓶中的溶液未扩散到水槽里)
A. 3:3:2 B. 2:2:3 C. 1:1:1 D. 2:2:1
难度: 困难查看答案及解析
-
体积为V mL,密度为ρ g/mL的含有相对分子质量为M的某种物质的溶液,其中溶质为mg,其物质的量浓度为c mol/L,溶质的质量分数为w%,则下面表示正确的是
A.
B.
C.
D.
难度: 困难查看答案及解析