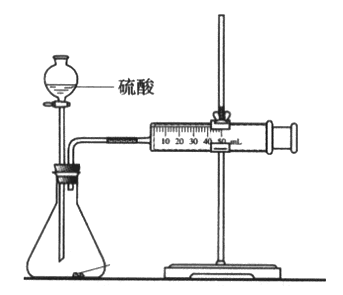
-
下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是
A. 升高温度
B. 用Zn粉代替Zn粒
C. 改用0.1mol/LH2SO4与Zn反应
D. 滴加少量的CuSO4溶液
难度: 简单查看答案及解析
-
被称为人体冷冻学之父的罗伯特·埃廷格(Robert Ettinger)在1962年写出《不朽的前景》(The Prospect Of Immortality)一书。他在书中列举了大量事实,证明了冷冻复活的可能。比如,许多昆虫和低等生物冬天都冻僵起来,春天又自动复活。下列结论中与上述信
息相关的是
A. 温度越低,化学反应越慢 B. 低温下分子无法运动
C. 温度降低,化学反应停止 D. 化学反应前后质量守恒
难度: 简单查看答案及解析
-
下列添加在食品中的试剂,其使用目的与反应速率有关的是
A. 火腿中添加防腐剂 B. 酸奶中添加增稠剂
C. 食盐中添加补碘剂 D. 酱油中添加补铁剂
难度: 简单查看答案及解析
-
在2A+B=3C+4D反应中,表示该反应速率最快的数据是
A. v(A)=0.5mol·L-1·s-1 B. v(B)=3mol·L-1·min-1
C. v(C)=0.9mol·L-1·s-1 D. v(D)=1.0mol·L-1·s-1
难度: 中等查看答案及解析
-
图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是
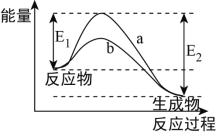
A. 该反应为吸热反应 B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同 D. 降低温度有利于该反应向正反应方向进行
难度: 中等查看答案及解析
-
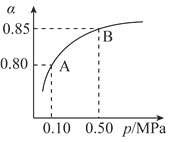
在K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O
2CrO42-(黄色)+2H+。向K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是
A. 加入X溶液,上述平衡正向移动
B. Cr2O72-的物质的量浓度增大
C. X溶液可能是NaOH溶液
D. 再加入H2SO4,可使黄色溶液变为橙色
难度: 中等查看答案及解析
-
已知在25℃,101kPa下,1g液态C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
A. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g)ΔH=-48.40kJ·mol-1
B. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)ΔH=-5518kJ·mol-1
C. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)ΔH=-5518kJ
D. C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g)ΔH=-5518kJ·mol-1
难度: 简单查看答案及解析
-
图为H2与O2反应生成H2O(g)的能量变化示意图:
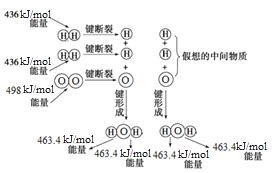
下列有关叙述不正确的是
A. 1molH2分子断键需要吸收436kJ的能量
B. H2(g)+1/2O2(g)=H2O(g)ΔH=-241.8kJ/mol
C. 分解1mol气态水生成氢气和氧气总共需要吸收926.8kJ的热量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量大
难度: 中等查看答案及解析
-
对于固定体积的密闭容器中进行的反应:A(g)+B(g)
C(g)+2D(g),不能说明在恒温下可逆反应已经达到平衡状态的是
①反应容器中压强不随时间变化而变化
②单位时间内生成A的物质的量与消耗D的物质的量之比为1:2
③混合气体的平均摩尔质量不随时间变化而变化
④反应混合气体的密度不随时间变化而变化
A. ②④ B. ③④ C. ①③ D. ①②
难度: 中等查看答案及解析
-
一定温度下,某反应达平衡,平衡常数K=c(CO).c(H2O)/[c(CO2).c(H2)]。保持容器容积不变,升高温度,H2浓度减小,则下列说法不正确的是
A. 该反应的焓变为正值
B. 恒温恒容下,再充入CO2气体,H2浓度一定减小
C. 升高温度,会使正反应速率增大,逆反应速率减小,平衡正移
D. 该反应化学方程式为CO2+H2
CO+H2O
难度: 中等查看答案及解析
-
已知分解1molH2O2放出热量98kJ。在含少量I-的溶液中,H2O2分解的机理为H2O2+I-→H2O+IO-慢H2O2+IO-→H2O+O2+I-快下列有关该反应的说法不正确的是
A. 反应速率与I-浓度有关 B. I-是该反应的催化剂
C. 生成1molO2放热196kJ D. v(H2O2)=v(H2O)=v(O2)
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 开启可乐瓶后,瓶中马上泛起大量泡沫
B. 实验室用过氧化氢制取氧气时,常常加入MnO2固体
C. 实验室常用排饱和食盐水的方法收集氯气
D. 工业上采用高压条件合成氨气
难度: 简单查看答案及解析
-
在一定条件下,在容积为2L的恒容密闭容器中,将2molN气体和3molM气体相混合,发生如下反应:2N(g)+3M(g)
xQ(g)+3R(g),4s后该反应达平衡时,生成2.4molR,并测得Q的反应速率为0.1mol/(L·s),下列有关叙述正确的是
A. N的转化率为80% B. 0~4s内,混合气体的平均相对分子质量不变
C. x值为2 D. 平衡时M的浓度为0.6mol/L
难度: 中等查看答案及解析
-
下列说法正确的是
A. Ba(OH)2·8H2O与NH4Cl的反应、铝片与稀盐酸的反应都是放热反应
B. 酸、碱稀溶液的中和热方程式可表示为:H+(aq)+OH-(aq)=H2O(1) ΔH= - 57.3kJ·mol-1
C. 由C(s,石墨)→C(s,金刚石)ΔH=+1.9kJ·mol-1可知,金刚石比石墨稳定
D. 催化剂的使用对化学反应的反应热(ΔH)不产生影响
难度: 中等查看答案及解析
-
已知NO2和N2O4可以相互转化2NO2
N2O4ΔH<0。现将一定量NO2和N2O4的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如下图。下列说法不正确的是
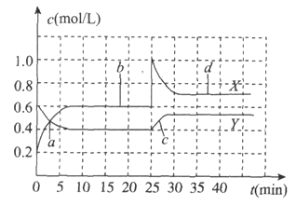
A. 反应进行至25min时,曲线发生变化的原因是加入0.4molNO2
B. a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C. 图中共有两条曲线X和Y,其中曲线X表示NO2浓度随时间的变化
D. a点c(NO2)=c(N2O4),因此v(正)=v(逆)
难度: 中等查看答案及解析
-
下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
A
B
C
D
反应装置或图像



实验现象或图像信息
温度计的水银柱上升
反应物总能量大于生成物总能量
反应开始后,针筒活塞向右移动
反应开始后,甲处液面低于乙处液面
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)
2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见右表。下列说法正确的是
温度
平衡浓度/(mol·L-1)
c(NH3)
c(CO2)
T1
0.1
T2
0.1
A. 若T2>T1,则该反应的ΔH<0
B. T1、T2时,H2NCOONH4转化的Δn(T2)
2Δn(T1)
C. NH3体积分数不变时,说明该反应达到平衡
D. 向容器中充入N2,H2NCOONH4质量增加
难度: 中等查看答案及解析
-
已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“2Fe3++2I-
2Fe2++I2”的是
实验编号
实验操作
实验现象
滴入KSCN溶液
溶液变红色
滴入AgNO3溶液
有黄色沉淀生成
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
滴入淀粉溶液
溶液变蓝色
A. ①和② B. ②和④ C. ③和④ D. ①和③
难度: 简单查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
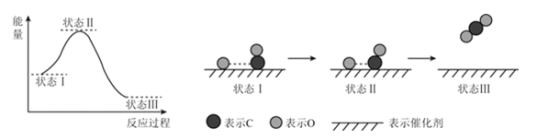
下列说法中正确的是
A. CO和O生成CO2是吸热反应 B. 在该过程中,CO断键形成C和O
C. CO和O生成了CO2 D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
根据下列操作和现象,所得结论正确的是
实验操作及现象
实验结论
A
向2mL5%的双氧水中分别滴加2滴0.1mol/L的Fe2(SO4)3和0.1mol/L的CuSO4溶液,前者产生气泡较快
对双氧水分解催化效率:Fe3+>Cu2+
B
向2mL0.1mol/L酸性KMnO4溶液中分别滴加3mL0.1mol/L和3mL0.2mol/L的H2C2O4溶液,后者首先褪色(提示:反应的部分关系为2MnO4-+5H2C2O4—2Mn2++10CO2)
其他条件不变时,H2C2O4的浓度越大,化学反应速率越快
C
取两支试管a和b,各加入5ml0.1mol/LNa2S2O3溶液;另取两支试管c和d,各加入5ml0.1mol/LH2SO4溶液;将a、d放入热水浴中,b、c放入冷水浴中,一段时间后分别混合,热水浴中先出现浑浊。(S2O32-+2H+=SO2↑+S↓+H2O)
温度越高,反应速率越快
D
用3mL稀H2SO4溶液与足量Zn反应,当气泡稀少时,加入1mL浓H2SO4,又迅速产生较多气泡
H2SO4浓度增大,反应速率加快
A. A B. B C. C D. D
难度: 中等查看答案及解析