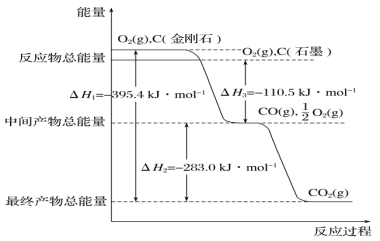
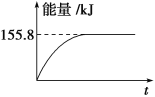
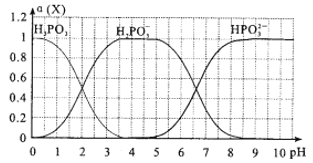
-
现有常温下的四份溶液:①0.01mol/LCH3COOH;②0.01mol/L盐酸;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A. ①中水的电离程度最小,③中水的电离程度最大
B. 将②、③混合,若有pH=7,则消耗溶液的体积:②>③
C. 将四份溶液稀释相同倍数后,溶液的pH:③>④,②>①
D. 将①、④混合,混合溶液pH>7,则消耗溶液的体积:④>①
难度: 中等查看答案及解析
-
下列关于0.10 mol·L-1 KHSO3溶液的说法正确的是
A. 25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
B. 溶质的电离方程式为KHSO3 = K++H++SO32−
C. 温度升高,c(HSO3−)增大
D. 离子浓度关系:c(K+)+c(H+)=c(OH-)+c(HSO3−)+c(SO32−)
难度: 中等查看答案及解析
-
下列有关实验操作或测量数据的说法正确的是
A. 用托盘天平称量食盐的质量为12.35g
B. 用碱式滴定管量取高锰酸钾溶液20.00mL
C. 用pH 试纸测量次氯酸钠溶液的pH为11
D. 中和热的测定实验中,NaOH溶液应该稍过量
难度: 简单查看答案及解析
-
下列根据反应原理设计的应用,不正确的是
A. CO32-+H2O
HCO3-+OH- 热的纯碱溶液清洗油污
B. Al3++3H2O
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量)
TiO2·xH2O↓+4HCl 用TiCl4制备TiO2
D. SnCl2+H2O
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
难度: 简单查看答案及解析
-
以下自发反应可以用熵判据来解释的是
A. N2(g)+2O2(g)===2NO2(g) ΔH=+67.7 kJ·mol-1
B. CaO(s)+CO2(g)===CaCO3(s) ΔH=-175.7 kJ·mol-1
C. (NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ·mol-1
难度: 简单查看答案及解析
-
已知反应:2NO(g)+Br2(g)
2NOBr(g) △H=-a kJ·mol-1(a>0),其反应机理是
① NO(g)+Br2 (g)
NOBr2 (g) 快 ② NOBr2(g)+NO(g)
2NOBr(g) 慢
下列有关该反应的说法正确的是
A. 该反应的速率主要取决于①的快慢
B. NOBr2是该反应的催化剂
C. 增大Br2 (g)的浓度能增大活化分子百分数,加快反应速率
D. 总反应中生成物的总键能比反应物的总键能大a kJ·mol-1
难度: 中等查看答案及解析
-
在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
难度: 中等查看答案及解析
-
加热N2O5,依次发生的分解反应为:①N2O5(g)
N2O3(g)+O2(g),②N2O3(g)
N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为
A. 4.25 B. 8.5 C. 17 D. 22.5
难度: 困难查看答案及解析
-
工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键
C-H
C=C
H-O
C-C
C-O
键能/kJ·mol-1
413
615
463
348
351
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
难度: 中等查看答案及解析
-
对水样中M的分解速率的影响因素进行研究。 在相同温度下,M的物质的量浓度[c(M)]随时间(t)的变化如下图所示。下列说法错误的是
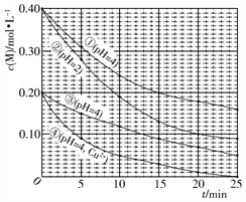
A. 水样酸性越强,M的分解速率越快
B. 水样中添加Cu2+,能加快M的分解速率
C. 由②③得,反应物浓度越大,M的分解速率越快
D. 在0~20 min内,②中M的分解速率为0.015 mol·L−1·min−1
难度: 中等查看答案及解析
-
醋酸的电离方程式为CH3COOH(aq)
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
难度: 简单查看答案及解析
-
在恒温、恒容条件下发生下列反应:2X2O5 (g)
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s
0
50
100
150
c(X2O5) mol/L
4.00
2.50
2.00
2.00
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (L•s)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
难度: 中等查看答案及解析
-
在恒容密闭容器中,将10 mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g)
COS(g)+H2(g) K=1,平衡后CO物质的量为8 mol。下列说法正确的是
A. CO.H2S的转化率之比为1:1
B. 达平衡后H2S的体积分数为4%
C. 升高温度,COS浓度减小,表明该反应是吸热反应
D. 恒温下向平衡体系中再加入CO.H2S.COS.H2各1 mol,平衡不移动
难度: 困难查看答案及解析
-
常温下,将100 mL 1 mol·L-1的氨水与100 mL a mol·L-1盐酸等体积混合,忽略反应放热和体积变化,下列有关推论不正确的是
A. 若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B. 若a=2,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C. 若a=0.5,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. 若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=1
难度: 困难查看答案及解析
-
常温下,向1 L 0.1 mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如下图所示。下列叙述正确的是
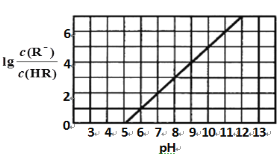
A. 0.1 mol·L-1 HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
难度: 困难查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A. 在0.1mol•L-1 Na2SO3溶液溶液中:c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3)
B. 在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-) + 2c(H2CO3)
C. 向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D. 常温下,CH3COONa和CaCl2混合溶液中:c(Na+)+ c(Ca2+)=c(CH3COOH)+ c(CH3COO-)+2 c(Cl-)
难度: 中等查看答案及解析