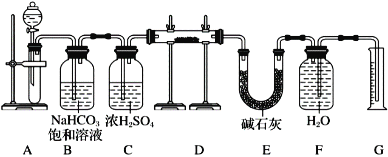
-
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
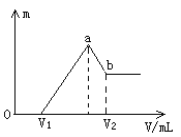
A. 取a克混合物充分加热,固体质量减轻b克
B. 取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C. 取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D. 取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
难度: 中等查看答案及解析
-
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+; Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,则:( )
A. 还原性Cr3+>Fe2+>SO2 B. 氧化性Cr2O72->SO2>Fe3+
C. Cr2O72-能将Na2SO3氧化成Na2SO4 D. 两个反应中Fe2(SO4)3均作还原剂
难度: 中等查看答案及解析
-
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是
A. 240 mL 0.2 mol·L-1 的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器
B. 向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体
C. 将10 mL 18.4 mol·L-1 浓硫酸加水稀释至1 L,稀释后溶液中H2SO4的物质的量浓度为0.184 mol·L-1
D. 用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出
难度: 简单查看答案及解析
-
下述对焰色反应实验操作注意事项的说明,正确的是
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④实验时最好选择本身颜色较浅的火焰
⑤没有铂丝时,也可以用光洁无锈的铁丝代替
A. 仅有③不正确 B. 仅有④不正确 C. 仅有⑤不正确 D. 全正确
难度: 简单查看答案及解析
-
下列关于钠的说法不正确的是( )
A. 金属钠和氧气反应,条件不同,产物不同
B. 钠长期置于空气中,表面不能形成致密氧化膜
C. 钠与水反应时,钠熔成小球在水面四处游动
D. 由于钠比较活泼,所以它能从溶液中置换出金属活动性顺序表中钠后面的金属
难度: 中等查看答案及解析
-
下列变化中,需要加入氧化剂才能实现的是
A. KMnO4→MnCl2 B. Fe→FeCl2 C. CaCO3→CO2 D. CuO→Cu
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 向Ba(OH)2溶液中滴加NaHSO4溶液至沉淀刚好完全:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B. AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
C. 向碳酸氢钙溶液中加入过量氢氧钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D. 澄清石灰水和碳酸钠溶液反应: Ca(OH)2+CO32- = CaCO3↓+2OH-
难度: 中等查看答案及解析
-
下列关于金属性质的叙述中,正确的是
A. 1 mol Na与足量盐酸反应消耗的HCl比1 mol Na在空气中久置后再与足量盐酸反应消耗的HCl少
B. 打磨的铝箔加热至熔化时,铝会滴落
C. 点燃镁之前,应先用砂纸打磨
D. 铁只能与氧气反应,与氯气不反应
难度: 中等查看答案及解析
-
下列关于Na2O与Na2O2的比较,正确的是( )
A. Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B. Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C. Na2O2和CO2的反应中,Na2O2既是氧化剂,又是还原剂
D. Na2O2与水反应时,1 mol Na2O2参与反应转移2 mol 电子
难度: 中等查看答案及解析
-
把Ba(OH)2溶液滴入明矾[KAl(SO4)2·12H2O]溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A. Al3+ B. AlO2- C. Al(OH)3 D. Al3+和Al(OH)3
难度: 中等查看答案及解析
-
下列示意图与对应的反应情况正确的是
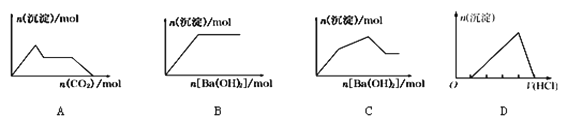
A. 含0.01 mol NaOH和0.01 mol Ba(OH)2的混合溶液中缓慢通入CO2
B. KHCO3溶液中逐滴加入Ba(OH)2溶液
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. 向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸
难度: 中等查看答案及解析
-
对Na2O2与CO2和H2O(g)混合气体的反应来说,下列说法错误的是
A. 只要参加反应的Na2O2一定,反应生成的氧气就一定
B. 只要CO2和H2O(g)的总的物质的量一定,反应所消耗的Na2O2的量就一定
C. 只要气体的总物质的量一定,反应中所转移的电子的物质的量就一定
D. 只要混合气体的总物质的量一定,固体所增加的质量就一定
难度: 中等查看答案及解析
-
等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则AlCl3和NaOH两种溶液物质的量浓度之比是
① 1 : 3 ② 1 : 4 ③ 2 : 3 ④ 2 : 7.
A. ③④ B. ①② C. ②④ D. ①③
难度: 困难查看答案及解析
-
下列关于物质或离子检验的叙述正确的是
A. 在溶液中加硝酸酸化后再加BaCl2溶液有白色沉淀,证明原溶液中一定有SO42-
B. 气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+
D. 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
难度: 简单查看答案及解析
-
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别
A. NaHCO3(aq)和 稀HNO3(aq) B. NaOH(aq)和Al2(SO4)3(aq)
C. Ca(OH) 2(aq)和NaHCO3(aq) D. Ba(OH)2(aq)和Na2SO4(aq)
难度: 简单查看答案及解析