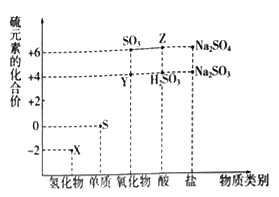
-
下列化合物:①Na2O2、 ②Fe(OH)3 、③FeCl2、④CuS、⑤H2SiO3、⑥NaHCO3,其中不能通过化合反应制得的有几项?
A. 一项 B. 二项 C. 三项 D. 四项
难度: 中等查看答案及解析
-
在一定条件下,氯气与碘单质以等物质的量进行反应,可得到一种红棕色液体ICl,ICl有很强的氧化性,ICl跟Zn、H2O反应的化学方程式如下:
2 ICl +2 Zn = ZnCl2+ZnI2 ICl+H2O = HCl+HIO
下列关于ICl性质的叙述正确的是( )
A.ZnCl2是氧化产物,又是还原产物
B.ZnI2是氧化产物,又是还原产物
C.ICl跟H2O的反应,ICl是氧化剂,H2O是还原剂
D.ICl跟H2O的反应,是自身氧化还原反应
难度: 中等查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生,当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该盐可以是
A. Fe2(SO4)3 B. KNO3 C. FeSO4 D. Na2CO3
难度: 中等查看答案及解析
-
合成新物质是研究化学的主要目的之一.意大利科学家最近合成了一种新型的氧分子O4.下列关于O4的说法中,正确的是( )
A. O4是一种新型的化合物
B. 1个O4分子由两个O2分子构成
C. 等质量的O4和O2含氧原子数目相同
D. O4和O2可通过氧化还原反应实现转化
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B. 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化
C. Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D. 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是( )。
A. 常温常压下,11.2 L氧气所含的原子数为NA
B. 含NA个H2SO4分子的浓硫酸与足量铜反应可制得0.5mol SO 2
C. 15.6 g Na2O2与过量CO2反应时,转移的电子数为0.2NA
D. 标准状况下,0.5mol NO和0.5mol O2组成的混合气体,体积约为22.4L
难度: 中等查看答案及解析
-
下列反应的离子方程正确的是( )
A. 钠与水反应:Na+2H2O=Na++2OH﹣+H2↑
B. Fe Cl3溶液中加入足量的氨水:Fe3++3OH﹣=Fe (OH)3↓
C. 钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
D. 用小苏打治疗胃酸过多:HCO3﹣+H+=CO2↑+H2O
难度: 中等查看答案及解析
-
NaNO2像食盐一样有咸味,有很强的毒性,误食亚硝酸钠(NaNO2)会使人中毒.已知亚硝酸钠能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是( )
A. 该反应的氧化剂为HI
B. 反应产物中能使淀粉变蓝的物质有I2、NaI
C. 该反应中氧化剂与还原剂物质的量之比为1:1
D. 人误食亚硝酸钠中毒时,可以服用HI溶液解毒
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. S在过量的O2中充分燃烧,可得SO3
B. 除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2
C. 鉴别NaHCO3溶液与Na2CO3溶液,可用澄清的石灰水
D. 等物质的量Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2:1
难度: 中等查看答案及解析
-
向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列说法正确的是( )
A. Cu与Cu2O 的物质的量之比为1:2
B. 产生的NO的体积为4.48L
C. 硝酸的物质的量浓度为2.6mol/L
D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
①强碱性溶液中: K+、HCO3-、Cl-、SO42-
②小苏打溶液: K+、SO42-、Cl-、H+
③含有0.1mol/L Ca2+的溶液中: Na+、K+、CO32-、Cl-
④室温下,强酸性溶液中: Na+、Fe3+、NO3-、SO42-
⑤使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
⑥常温pH<7的溶液: K+、Ba2+、Cl-、Br-
A. 二项 B. 三项 C. 四项 D. 五项
难度: 中等查看答案及解析
-
分类方法在化学学科的发展中起到重要的作用。下列分类标准不合理的是 ( )
①根据元素原子最外层电子数的多少将元素分为金属和非金属
②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质
③依据组成元素的种类,将纯净物分为单质和化合物
④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等
⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物
⑥根据分散系的稳定性大小,将分散系分为胶体、浊液和溶液
⑦依据有无电子转移,将化学反应分为氧化还原反应和非氧化还原反应
⑧根据化学反应的热效应,将化学反应分为放热反应、吸热反应
⑨根据溶液导电能力强弱,将电解质分为强电解质、弱电解质
A. ①④⑤⑥⑨ B. ③④⑤⑥⑧ C. 只有①③ D. 全部正确
难度: 中等查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是
A. 分离碘和酒精
B. 除去Cl2中的HCl
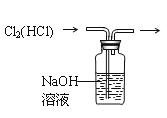
C. 实验室制氨气
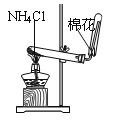 D. 排水法收集NO
D. 排水法收集NO难度: 中等查看答案及解析
-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色,再向反应后的溶液中通入过量SO2,溶液变成无色。下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 滴加KI溶液时,KI被氧化,CuI是氧化产物
B. 当有22.4 L SO2参加反应时,有2NA个电子发生转移
C. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
D. 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
难度: 中等查看答案及解析
-
下列工业生产的反应原理不涉及氧化还原反应的是( )
A.钢铁厂高炉炼铁
B.工业上以氨气为原料用氨碱法生产纯碱
C.硝酸厂以氨气为原料制取硝酸
D.氯碱厂利用氯化钠生产氯气和烧碱
难度: 中等查看答案及解析
-
《本草图经》中关于绿矾的分解有如下描述:“绿矾形似朴消(Na2SO4·10H2O)而绿色,取此物置于铁板上,聚炭,封之囊袋,吹令火炽,其矾即沸,流出,色赤如融金汁者是真也。”对此段话的说明中肯定错误的是( )
A. 绿矾的化学式为FeSO4·7H2O B. 绿矾分解过程中没有发生电子的转移
C. “色赤”物质可能是Fe2O3 D. 流出的液体中可能含有硫酸
难度: 困难查看答案及解析
-
某同学设计下列实验装置进行卤素的性质实验.玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
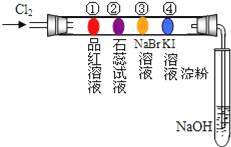
①
②
③
④
A
白色
先变红后无色
橙色
蓝色
B
白色
红色
橙色
紫色
C
无色
白色
橙色
蓝色
D
白色
无色
无色
紫色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验处理,结果得到酸性溶液,还有少量气体剩余,则气体甲的组成可能为( )
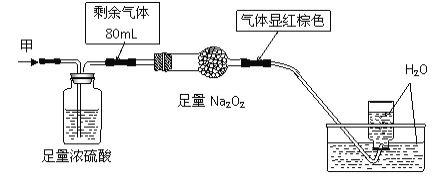
A. NH3、NO2、N2 B. NH3、NO、CO2
C. NH3、NO2、CO2 D. NO、CO2、N2
难度: 困难查看答案及解析
-
为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A. 原溶液中一定含有SO42- B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl- D. 原溶液中一定含有Fe3+
难度: 中等查看答案及解析
-
将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出强氧化性
难度: 中等查看答案及解析
-
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是( )

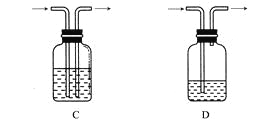
难度: 中等查看答案及解析
-
下列实验过程中没有沉淀出现的是
A. 向常温时的饱和碳酸钠溶液中通入足量CO2气体 B. 向硝酸钡溶液中通入SO2气体
C. 向氯化钙溶液中通入SO2气体 D. 向次氯酸钙溶液中通入CO2气体
难度: 中等查看答案及解析
-
Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为
A. 2.25mol/L B. 2mol/L C. 4mol/L D. 0.6mol/L
难度: 困难查看答案及解析