-
化学与生产、生活密切相关,下列说法错误的是
A. 用K2FeO4处理自来水,既可杀菌消毒又可除去悬浮杂质
B. NH4MgPO4·6H2O(鸟粪石)与草木灰混合施肥效果更好
C. 将地沟油回收加工为生物柴油,既可获得能源物质又可防止水体污染
D. 医院常用含碘2%~3%的酒精溶液用作医疗消毒剂,因为它能使蛋白质变性
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
选项
性质
用途
A
FeCl3溶液显弱酸性
FeCl3可用作H2S的脱除剂
B
二氧化硅熔点高
二氧化硅可用于制备光导纤维
C
氢氟酸呈酸性
氢氟酸可用在玻璃器皿上刻蚀标记
D
H2O2能使蛋白质变性
H2O2可用作医疗行业的消毒剂
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列有关说法正确的是
A. 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+的数目为NA
B. 标准状况下,2.24 L甲醇中含有C—H键的数目为0.3NA
C. 0.1 mol·L-1的Na2CO3溶液中,阳离子的总数为0.2NA
D. 将1 mol Cl2通入水中,HClO、Cl-、ClO-的粒子数之和为2NA
难度: 中等查看答案及解析
-
脱落酸有催熟作用,可延长鲜花盛开时间,其结构简式如图所示,下列关于脱落酸的说法错误的是
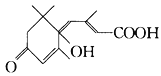
A. 所有碳原子均处于同一平面
B. 二氯代物超过两种
C. 存在酯类同分异构体
D. 一定条件下,可与4 mol H2发生加成反应
难度: 中等查看答案及解析
-
下列有关实验操作的叙述错误的是
A. 过滤操作中,漏斗的尖端应接触烧杯内壁
B. 向容量瓶中转移液体时,引流用的玻璃棒可以接触容量瓶内壁
C. 配制5%NaCl溶液时,必须用到的玻璃仪器是容量瓶、烧杯、胶头滴管、玻璃棒
D. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
难度: 简单查看答案及解析
-
硼化钒(VB2)-空气电池是目前储电能力最高的电池,示意图如图所示,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法错误的是

A. 电极a的电势比VB2极的高
B. VB2极的电极反应式为2VB2-22e-+22OH-=2B2O3+V2O5+11H2O
C. 放电时,OH-由VB2极向a电极移动
D. 若采用稀盐酸作电解质溶液,则该电池发生的总反应改变
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最简单氢化物是天然气的主要成分,W与Y的最外层电子数之和等于X的最外层电子数,且W、X、Y、Z的最外层电子数均为偶数;向X、Y、Z组成的一种化合物中加入盐酸,产生的气体能使品红溶液褪色。下列说法不正确的是
A. Z与X同主族 B. X、Y的简单离子的电子层结构相同
C. WZ2中只含有共价键 D. W、X两种元素只能形成一种化合物
难度: 简单查看答案及解析