-
浓度为0.1 mol·L-1的HCl溶液VmL,加水稀释到2VmL,取出10 mL,这10 mL溶液中含有c(H+)( )
A. 0.5 mol·L-1 B. 0.01 mol·L-1 C. 0.02 mol·L-1 D. 0.05 mol·L-1
难度: 简单查看答案及解析
-
现将AlCl3、MgCl2、MgSO4、Al2(SO4)3四种物质溶于水,形成的混合溶液中c(Al3+)=0.1 mol•L﹣1、c(Mg2+)=0.25 mol•L﹣1、c(Cl﹣)=0.2 mol•L﹣1,则该溶液中c(SO42-)为( )
A. 0.15 mol•L﹣1 B. 0.2 mol•L﹣1 C. 0.25 mol•L﹣1 D. 0.30 mol•L﹣1
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A. 在常温常压下,28 g N2与CO混合物气体中所含的分子数目一定为NA
B. 标准状况下,17 g氨气所含原子数目为NA
C. 在常温常压下,11.2 L氮气所含的原子数目为NA
D. NA个氢分子所占有的体积一定为22.4 L
难度: 困难查看答案及解析
-
在碱性溶液中能大量共存且溶液为无色透明的离子组是( )
A. K+、MnO4-、Na+、Cl- B. K+、Na+、NO3-、CO32-
C. Na+、H+、NO3-、SO42- D. Fe3+、Na+、Cl-、SO42-
难度: 中等查看答案及解析
-
等体积的两容器内,一个盛CH4,另一个盛NH3,若容器内温度、压强相同,则两容器内所盛气体比较,结论一定不正确的是( )
A. 分子个数比为1∶1 B. 原子个数比为5∶4
C. 质量比为17∶16 D. 氢原子个数比为4∶3
难度: 简单查看答案及解析
-
为确定某溶液中是否存在Cl﹣、SO42-和CO32-,进行如下实验:
①取少量溶液滴加Ba(NO3)2溶液,产生白色沉淀。
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解。
③取上层清夜继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。
根据实验,以下推测不正确的是( )
A. 一定有SO42- B. 一定有CO32-
C. 不能确定Cl﹣是否存在 D. 不能确定SO42-是否存在
难度: 简单查看答案及解析
-
下列反应的离子方程式书写中,正确的是( )
A. 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
B. 稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓
D. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
粗盐提纯实验的部分操作如图所示,其中错误的是( )
A. 取一定量的粗盐
 B. 溶解
B. 溶解
C. 过滤
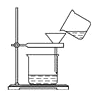 D. 蒸发
D. 蒸发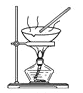
难度: 简单查看答案及解析
-
下列仪器:①漏斗、②容量瓶、③蒸馏烧瓶、④坩埚、⑤分液漏斗、⑥燃烧匙,常用于物质分离的是
A. ①③④ B. ①②⑥ C. ①③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
现有三组混合物:①CCl4和NaCl的混合液;②苯(沸点:80.1℃)和甲苯(沸点:110.6℃)的混合溶液(苯和甲苯是性质非常相似的一对互溶液体);③掺有碘化钾的碘水,分离以上各混合液的正确方法依次是
A. 分液、蒸馏、萃取 B. 萃取、蒸馏、分液
C. 蒸馏、萃取、分液 D. 分液、萃取、蒸馏
难度: 中等查看答案及解析
-
不是Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A. 都比较稳定,密封放置不产生沉淀 B. 都有丁达尔效应
C. 加入少量NaOH溶液都可产生沉淀 D. 分散质微粒均可透过滤纸
难度: 中等查看答案及解析