-
化学与STSE (社会、科学、技术和环境) 密切相关,下列说法不正确的是
A. 铁表面镀锌可以增强其抗腐蚀性
B. 寻找合适催化剂能使水转化为汽油
C. 合理利用太阳能、风能和氢能等能源有利于实现“低碳经济”
D. 钢铁在潮湿的空气中更容易生锈,其主要原因是形成了原电池
难度: 中等查看答案及解析
-
用情性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入物质的量为0.1mol的Cu2(OH)2CO3,恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解),则电解过程中转移的电子的物质的量为
A. 0.4mo1 B. 0.5mo1 C. 0.6mo1 D. 0.8mo1
难度: 困难查看答案及解析
-
下列措施或事实不能用勒沙特列原理解释的是( )
A. 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
B. H2、I2、HI平衡混合气加压后颜色变深
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 开启啤酒瓶后,瓶中马上泛起大量泡沫
难度: 简单查看答案及解析
-
下列热化学方程式说法正确的是
A. 由C(s,石墨)═C(s,金钢石) ΔH>0可知,石墨比金刚石稳定
B. CO的燃烧热是283.0kJ•mol-1,则2CO(g)+O2(g)═2CO2(g) ΔH= -283.0kJ•mol-1
C. 常温常压,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ•mol-1,则 HF(aq)+NaOH(aq)═NaF(aq)+H2O(l) ΔH= -57.3kJ•mol-1
D. 已知C(s)+O2(g)═CO2(g) ΔH1,C(s)+1/2O2(g)═CO(g) ΔH2, 则ΔH1>ΔH2
难度: 困难查看答案及解析
-
某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
难度: 中等查看答案及解析
-
NO2存在下列平衡:2NO2(g)
N2O4(g)+Q(Q>0) 在测定NO2的相对分子质量时,下列条件下测定结果最接近理论值的是
A. 温度130℃、压强3.03×105 Pa B. 温度25℃、压强1.01×105 Pa
C. 温度130℃、压强5.05×104 Pa D. 温度0℃、压强5.05×104 Pa
难度: 中等查看答案及解析
-
下列各组中的比值等于2:1的是 ( )
A.pH为12的烧碱溶液与Ba(OH)2溶液的物质的量浓度之比
B.K2S溶液中c(K+)与c(S2-)之比
C.相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)之比
D.10mL0.5mol/L的盐酸与5mL0.5mol/L的盐酸溶液中的c(H+)之比
难度: 简单查看答案及解析
-
下列实验操作不能达到目的的是
A. 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
B. 用加热蒸发K2CO3溶液的方法获得K2CO3晶体
C. 用Na2S溶液和CuSO4溶液反应制取CuS固体
D. 在通HCl气体的氛围中加热MgCl2溶液制取MgCl2固体
难度: 中等查看答案及解析
-
如图装置中发生反应的离子方程式:Cu+2H+=Cu2++H2↑,下列说法正确的是
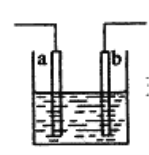
A. a、b不可能是同种材料的电极
B. 该装置可能是原电池,电解质溶液为稀盐酸
C. 该装置可能是a、b未形成闭合回路,电解质溶液是稀硝酸
D. 该装置可能是电解池,电解质溶液为稀盐酸
难度: 中等查看答案及解析
-
下列有关图示实验的说法正确的是
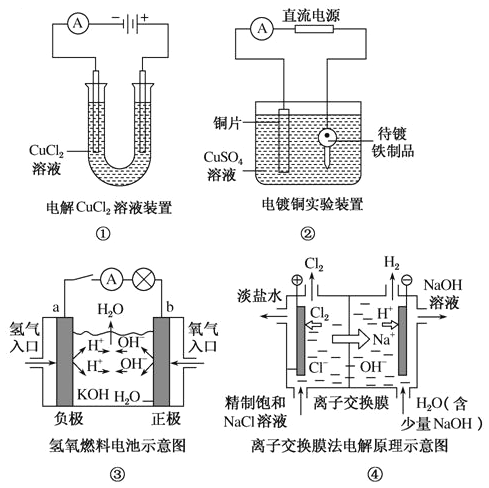
A. ①装置中阴极处产生的气体能够使湿润的KI—淀粉试纸变蓝
B. ②装置中待镀铁制品应与直流电源正极相连
C. ③装置中电子由b极流向a极
D. ④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
难度: 困难查看答案及解析
-
某同学用0.1000mol/L的氢氧化钠标准溶液滴定某未知浓度的醋酸溶液20mL,则下列叙述正确的是
A. 本实验可选用甲基橙为指示剂
B. 在滴定操作开始前,应洗涤并润洗滴定管和锥形瓶
C. 在滴定操作的碱式滴定管中有气泡,滴定结束时气泡消失,则测定结果偏大
D. 若达到滴定终点时,消耗NaOH溶液20.00mL,则原醋酸溶液的pH=1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
① 含有大量Fe3+的溶液: Na+、SCN-、Cl-、SO42-
② pH=11的溶液中: CO32-、Na+、NO3-、S2-、K+
③ 水电离的H+浓度为10-12mol/L的溶液中: NH4+、Na+、SO42-、HCO3-
④ 加入Mg能放出H2的溶液中: Mg2+、NO3-、NH4+、K+、S2O32-
⑤ 澄清溶液中: Fe3+、NO3-、Na+、C1-、SO42-
⑥ c(H+)/c(OH-)=1×10-12的溶液中: K+、Na+、CO32-、NO3-
⑦ 使甲基橙变红的溶液中: Cu2+、SO42-、NH4+、NO3-、C1-
A. ① ③ ⑤ ⑦ B. ① ④ ⑤ ⑥ C. ② ④ ⑤ ⑥ D. ② ⑤ ⑥ ⑦
难度: 困难查看答案及解析
-
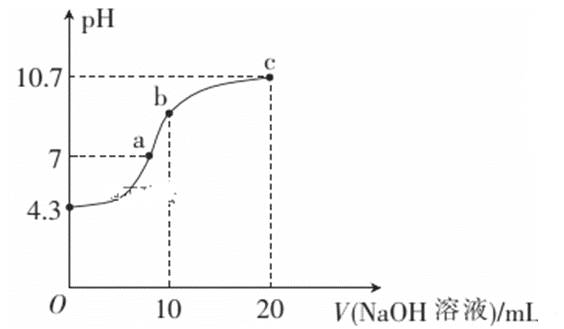
常温下,向l0mL0.1mol/L 的HR 溶液中逐渐滴入0.lmol/L 的NH3·H2O 溶液,所得溶液pH 及导电性变化如图。下列分析不正确的是
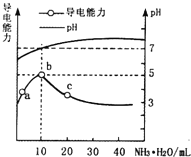
A. a~b点导电能力增强,说明HR为弱酸
B. b点溶液c(NH3·H2O)=c(R-)+c(H+)-c(OH-)
C. c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 常温下,HR 和NH3·H2O 的电离平衡常数近似相等
难度: 困难查看答案及解析
-
已知: H2(g)+I2(g)
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量
n(H2)/mol
n(I2)/mol
n(HI)/mol
甲
0.02
0.02
0
乙
0.04
0.04
0
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
难度: 困难查看答案及解析
-
Hg 是水体污染的重金属元素之一。水溶液中的二价汞的主要存在形态与Cl-、OH-的浓度关系如图所示[图中涉及的物质或粒子只有Hg(OH)2 为难溶物,粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-1gc(Cl-)]:
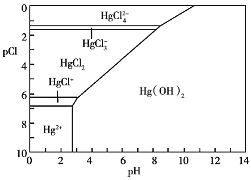
下列说法中错误的是
A. Hg(NO3)2固体溶于水通常会出现浑浊
B. 海水Cl-的浓度大于0.1mol/L,则其中汞元素的主要存在形态是Hg(OH)2
C. 少量Hg(NO3)2溶于0.001moL/L盐酸后得到澄清透明溶液
D. 已知Ksp(HgS)=1.6×10-52,当c(S2-)=1×10-5mo/L 时,c(Hg2+)=1.6×10-47mo/L
难度: 困难查看答案及解析
-
磷酸铁锂电池装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐。电池工作时的总反应为:LiFePO4 + 6C
Li1−xFePO4 +LixC6,则下列说法正确的是

A. 图中聚合物隔膜是阴离子交换膜
B. 充电时,Li+迁移方向是“由右向左”
C. 放电时,正极的电极反应式为LiFePO4 −xe− =Li1−xFePO4 + xLi+
D. 用该电池电解精炼铜,当转移电子1.25mol时能得到精铜32g,则电子利用率为80%
难度: 困难查看答案及解析