-
下列有关化学在日常生活中的应用, 说法正确的是
A. 生活中常用于消毒的酒精属于纯净物
B. 厨房里用食醋去水垢发生了氧化还原反应
C. 用热的纯碱溶液和用蒸馏汽油去油污均是化学变化
D. 炒菜所用铁锅出现红色的锈斑发生了电化学腐蚀
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是
A. 162g淀粉和纤维素混合物中氧原子的数目为5NA
B. 常温时,pH=5的盐酸中水电离的OH-数目为10-9NA
C. 5mol的CH3COONa固体溶于水所得溶液中CH3COO-数目为5NA
D. 22.4L Cl2与足量的铁反应,转移的电子数目为2NA
难度: 中等查看答案及解析
-
丙烯的结构简式如图所示, 下列关于丙烯说法不正确的是
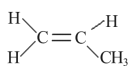
A. 能使酸性高锰酸钾溶液褪色
B. 至少有 1 种同分异构体
C. 最多 6 个原子共平面
D. 与氯化氢发生加成反应, 加成产物可能有两种
难度: 中等查看答案及解析
-
下列实验操作正确的是
实验
操作
A
证明某溶液中存在 Fe3+
先加少量氯水,再滴加 KSCN 溶液,出现血红色
B
除去 NaCl溶液中存在的 Na2SO3
向该溶液中加入适量的稀硝酸
C
分离氢氧化铝和氢氧化镁的混合物
将混合物溶于适量氢氧化钠溶液,过滤得Mg(OH)2;向滤液中通入过量氯化氢,过滤得Al(OH)3
D
制备氢氧化铁胶体
将少量饱和 FeCl3 溶液滴加入沸水中继续煮沸至溶液呈红褐色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有五种短周期主族元素 X、 Y、 Z、 M、 Q, 它们的原子序数逐渐增大; 在周期表中的位置如图所示, M 的电子层数与主族序数相等。 下列说法错误的是
A. 工业上用电解熔融的 Z 的氯化物制 Z
B. Y 和 Q 的最简单氢化物熔点: Y<Q
C. Z、 M、 Y 的简单离子半径: Y>Z>M
D. X 和 Y 的最简单氢化物的稳定性: X<Y
难度: 中等查看答案及解析
-
联盟学校某教师为了让学生观察到明显的实验现象,将教材铜锌单池原电池改为如图所示的双池电池。下列说法不正确的是
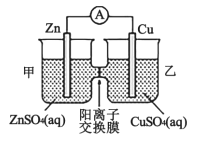
A. 铜电极是正极发生还原反应
B. 电池工作过程中甲池中c(Zn2+)几乎不变
C. 装置中发生的总反应是Cu2++Zn===Cu+Zn2+
D. 电子从锌电极经溶液流向铜电极
难度: 中等查看答案及解析
-
已知:pH=-lgc(H+),pOH=-lgc(OH-)。常温下,向某浓度的盐酸溶液中滴加氨水溶液,所得溶液pOH和pH变化如图所示。下列说法不正确的是
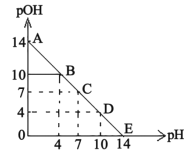
A. 盐酸的初始浓度为0.1mol∙L−1
B. B点溶液和D点溶液水电离的氢氧根离子浓度相等
C. C点溶液中c(NH4+)=c(Cl−)
D. 升高温度(高于25℃),滴定过程中pOH+pH<14
难度: 中等查看答案及解析
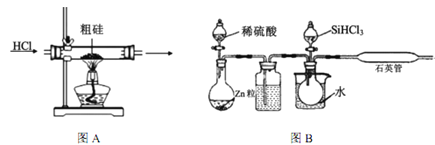

 该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。
该方法与用三氯氢硅氢还原法比较,其缺点至少有两处,分别是_________________。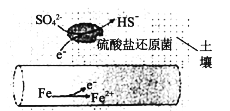
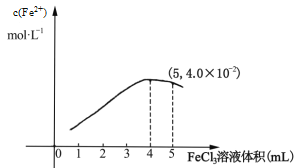

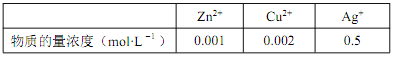
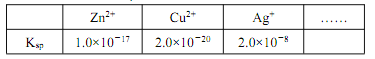
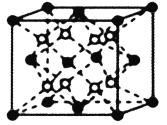
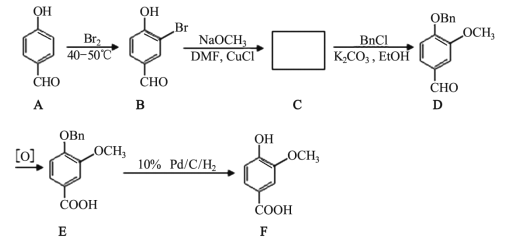
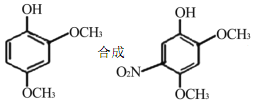 的合成线路图_____。
的合成线路图_____。