-
下列说法中正确的是
①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧产生的红棕色烟为FeCl3
⑤钠、氢气在氯气中燃烧都能产生白烟
A. ①② B. ②③ C. ③④ D. ④⑤
难度: 中等查看答案及解析
-
下列各组物质能相互反应得到Al(OH)3的是
A. Al与NaOH溶液共热 B. AlCl3与过量的NaOH溶液
C. Al2O3与水共热 D. Al2(SO4)3与过量氨水
难度: 中等查看答案及解析
-
过氧化钠跟足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却残留的固体物质是
A. Na2O2、Na2CO3 B. NaOH、Na2CO3
C. Na2CO3 D. Na2O2、NaOH、Na2CO3
难度: 困难查看答案及解析
-
下列氯化物中,既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的是
A. FeCl2 B. AlCl3 C. FeCl3 D. CuCl2
难度: 中等查看答案及解析
-
可用于治疗胃酸过多的物质是
A. 碳酸氢钠 B. 氯化钠 C. 氯化钾 D. 氢氧化钠
难度: 中等查看答案及解析
-
光纤通信是一种现代化的通信手段,制造光导纤维的主要原料是
A. Na2SiO3 B. Ag C. CaCO3 D. SiO2
难度: 简单查看答案及解析
-
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项
实验
现象
结论
A.
向足量含淀粉的FeI2溶液中滴加2滴氯水
溶液变蓝
还原性:I―>Fe2+
B.
向FeCl2溶液中加入足量Na2O2粉末
出现红褐色沉淀
FeCl2溶液部分变质
C.
向铜粉中加入0.1mol/LFeCl3溶液
溶液变蓝,试管底部有固体
3Cu+2Fe3+=2Fe+3Cu2+
D.
白铁皮(镀锌铁)出现刮痕后浸泡在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液
无明显现象
该过程未发生反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用铝合金代替铝制钥匙,因为铝合金
A. 熔点低 B. 不易锈蚀 C. 硬度大 D. 密度小
难度: 中等查看答案及解析
-
称取两份等质量的铝粉,分别加入等体积等物质量浓度的浓NaOH溶液与盐酸溶液。若最终铝全部溶解,则放出H2的体积比(同温同压下)是
A. 1:1 B. 1:2 C. 1:3 D. 3:1
难度: 中等查看答案及解析
-
向100 mL 0.250 mol/L的AlCl3溶液中加入金属钠完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是
A. 2.30 g B. 3.45g C. 1.15 g D. 0.575 g
难度: 简单查看答案及解析
-
将一粒钠投入下列溶液中,能产生气体和沉淀的是
A. NaCl B. BaCl2 C. H2SO4 D. CuCl2
难度: 简单查看答案及解析
-
潮湿氯气、新制氯水以及次氯酸钠溶液都能使有色布条褪色,因为它们都含有微粒
A. HClO B. ClO- C. HCl D. Cl2
难度: 中等查看答案及解析
-
下列各组中的两种物质相互反应,无论哪种过量,都可用同一个离子方程式表示的是
①碳酸钠溶液与稀盐酸 ②氯化铝溶液与氢氧化钠
③二氧化硫与氨水 ④漂白粉溶液和二氧化碳
⑤铝与氢氧化钠溶液 ⑥碳酸氢钠溶液与澄清石灰水
A. 仅有⑤ B. ①③⑥ C. ③⑤ D. ②④
难度: 中等查看答案及解析
-
某溶液中加入铝粉能产生氢气,在该溶液中一定不能大量共存的离子组是
A. Na+、K+、Cl-、ClO- B. Cu2+、Fe2+ 、HCO3-、SO42-
C. Na+、K+、Cl-、SO42- D. K+、 NH4+、 Cl-、SO42-
难度: 简单查看答案及解析
-
下列离子方程式错误的是
A. 盐酸与烧碱溶液反应:H++OH-===H2O
B. 澄清石灰水中通入CO2变浑浊:CO2+Ca2++2OH-===CaCO3↓+H2O
C. 向氯化铝溶液中加入足量氨水:Al3++3OH-===Al(OH)3↓
D. Cl2与水反应生成盐酸和次氯酸:Cl2+H2O
H++Cl-+HClO
难度: 中等查看答案及解析
-
向Fe2 (SO4)3 和Al2 (SO4)3 的混合溶液中,逐滴加入NaOH溶液至过量。下列图象中,能正确表示上述反应的是( )
A.
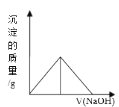 B.
B.  C.
C. 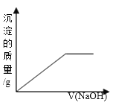 D.
D. 
难度: 中等查看答案及解析
-
根据如图的转化关系判断下列说法正确的是(反应条件已略去)
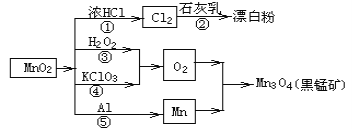
A. 反应①②③④⑤均属于氧化反应和离子反应
B. 反应⑤说明该条件下铝的还原性强于锰
C. 相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1
D. 反应①中氧化剂与还原剂的物质的量之比为1:4
难度: 困难查看答案及解析
-
证明某溶液含有Fe2+而不含有Fe3+的实验方法是
①先加氯水,后加KSCN溶液后显红色 ②先加KSCN溶液,不显红色,再加氯水后显红色 ③滴加NaOH溶液,先产生白色沉淀,迅速变为灰绿色,最后呈红褐色 ④只滴加KSCN溶液不显红色
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
如图所示,A处通入干燥的Cl2,打开B阀后,C处的湿润红布条逐渐褪色;关闭B阀时,C处的湿润红布条无明显现象。则D瓶中装的是

A. 浓硫酸 B. NaOH溶液
C. 浓盐酸 D. 饱和NaCl溶液
难度: 中等查看答案及解析
-
新制氯水的成分复杂,但饱和氯水久置后,成分发生变化,下列粒子①Cl2;②H2O;③Cl-;④HClO;⑤ H+,因饱和氯水久置而减少的是
A. ①②③ B. ①④ C. ②④ D. ①②④
难度: 中等查看答案及解析