-
下列不能用来鉴别Na2CO3和NaHCO3两种无色固体的实验操作是( )
A. 分别加热这两种固体,并将生成的气体通入澄清石灰水中
B. 分别在这两种物质中加入CaCl2溶液
C. 在两种固体物质中加入等浓度的稀盐酸
D. 分别在两种物质的溶液中加入澄清石灰水
难度: 简单查看答案及解析
-
将100 mL 3 mol·L-1的NaOH溶液与100 mL 3 mol·L-1的AlCl3溶液按下列两种方法混合:(1) 将NaOH溶液逐滴滴入AlCl3溶液中 (2) 将AlCl3溶液逐滴滴入NaOH溶液中,对上述实验所得结论正确的是
A. 现象相同,沉淀量相等 B. 现象相同,沉淀量不等
C. 现象不同,沉淀量相等 D. 现象不同,沉淀量不等
难度: 中等查看答案及解析
-
下列除去杂质的方法不正确的是( )
A. 镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B. 用过量氨水除去Fe3+溶液中的少量Al3+
C. 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D. Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
难度: 中等查看答案及解析
-
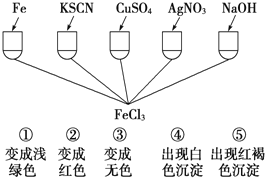
FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A. 加入KSCN溶液一定不变红色
B. 溶液中一定含Fe2+
C. 溶液中一定不含Cu2+
D. 剩余固体中一定含Cu
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. CO2通入NaAlO2溶液中:AlO2—+CO2+H2O===Al(OH)3↓+CO32-
B. Al2O3与过量氨水:Al2O3+6NH3·H2O===2Al3++6NH4+
C. 向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-===Al(OH)3↓
D. 向AlCl3溶液中滴入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
在一密闭容器中有HCHO、H2和O2混合气体共20g,放入足量Na2O2用电火花引燃,使其完全反应,Na2O2增重8g,则原混合气体中O2的质量分数是
A. 40% B. 33.3% C. 60% D. 36%
难度: 中等查看答案及解析
-
将铁屑溶于过量盐酸后,再加入下列物质,不会有三价铁生成的是
A. 硫酸 B. 氯水 C. 硝酸锌 D. 溴水
难度: 简单查看答案及解析
-
下列各项所述内容对应的图象正确的是
A
B
C
D
向含有H +、Al 3+、Mg 2+的溶液中逐滴加入NaOH
向Al 2(SO 4) 3溶液中加入Ba(OH) 2
等物质的量的镁和铝分别与等浓度等体积的过量稀硫酸反应
向AlCl3溶液中加氨水
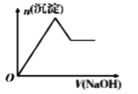
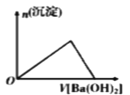
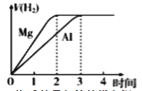
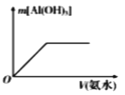
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将50 mL某未知浓度的AlCl3溶液分别加到60 mL 1 mol·L-1的NaOH溶液或60 mL 3 mol·L-1的NaOH溶液中,均能得到1.56 g Al(OH)3沉淀。则此AlCl3溶液的浓度可能是( )
A. 1 mol·L-1 B. 0.5 mol·L-1 C. 0.6 mol·L-1 D. 0.4 mol·L-1
难度: 困难查看答案及解析
-
下列叙述正确的是( )
① 含有大量AlO2-的溶液中,NH4+、NO3-、H+、Cl-可以大量共存
② 0.1 mol•L-1的AlCl3溶液中,Na+、K+、SO42-、HCO3-可以大量共存
③ 向AlCl3溶液中加入过量的稀氨水,发生反应:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
④ 加入铝粉能放出H2的溶液中,Ca2+、Fe2+、Cl-、NO3-一定能够大量共存
⑤ 用NaOH溶液除去铝条表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O
⑥ 依据铝热反应原理,能发生反应2Al+3MgO
3Mg+Al2O3
⑦ 向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO42-+2Ba2++Al3++4OH-=2BaSO4↓+AlO2-+2H2O
⑧ 常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A. ⑤⑦ B. ②③⑤ C. ④⑤⑥ D. ②⑦⑧
难度: 中等查看答案及解析
-
为测定某镁铝合金样品中铝的含量,进行下列实验:取一定量合金,加入l00mL 0.3mol·L-1稀硫酸,合金完全溶解,产生的气体在标况下为560mL;再加入0.2mol·L-1NaOH溶液至沉淀质量不再变化,用去350mLNaOH溶液。则所取样品中铝的物质的量为( )
A. 0.005mol B. 0.01mol C. 0.025mol D. 0.03mol
难度: 简单查看答案及解析
-
为除去括号内的杂质,所选用的试剂或方法不正确的是
A.CO2(HCl),选用饱和NaHCO3溶液
B.NaHCO3溶液(Na2CO3),应通入过量CO2气体
C.Na2O2粉末(Na2O),将混合物在空气中加热
D.镁粉(铝粉),选用过量的烧碱溶液
难度: 中等查看答案及解析
-
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间因果关系的判断,完全正确的是( )
选项
陈述I
陈述II
判断
A
铝制炊具最好不要盛放酸性或碱性较强的液体食物
因为Al和Al2O3既可以与酸反应又可以与碱反应
I对,Ⅱ对,有
B
铝箔在酒精灯火焰上加热熔化但不滴落
因为铝箔对熔化的铝有较强的吸附作用
I对,II对,有
C
海啸使水源发生污染可用明矾进行消毒和净化
因为明矾水解生成Al(OH)3胶体,具有吸附性
I对,II错,无
D
铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸
因为铁和铝不能与浓硫酸或浓硝酸反应
I错,II对,无
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
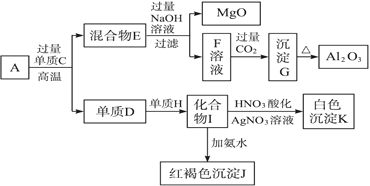
某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法中不正确的是
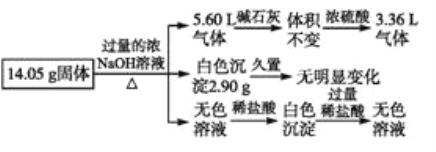
A. 该固体中一定没有FeCl2,可能含有AlCl3
B. 该固体中含有2.70 g Al
C. 该固体中含有6.60 g (NH4)2SO4
D. 该固体中含有4.75 g MgCl2
难度: 中等查看答案及解析
-
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下图。下列说法正确的是
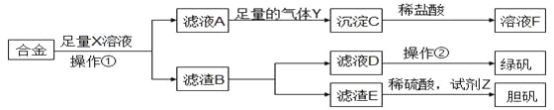
A. 溶液X为稀硫酸,气体Y为氨气
B. 由溶液F获得溶质F固体的过程中,须控制条件防止其氧化和分解
C. 使用足量稀硫酸时,试剂Z选用H2O2或适量HNO3均获得胆矾晶体
D. 操作①为过滤,操作②为蒸发结晶、洗涤、干燥
难度: 中等查看答案及解析