-
通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。对下列反应的推断或解释正确的是( )
选项
操作
可能的实验现象
解释
A
向FeCl2溶液中滴入用硫酸酸化的H2O2溶液
溶液变黄
发生氧化还原反应,且氧化性:H2O2>Fe3+
B
将CO2 通入Ba(NO3)2溶液中
有白色沉淀生成
CO2与Ba(NO3)2反应生成BaCO3
C
某溶液中加入硝酸酸化的氯化钡溶液
有白色沉淀生成
溶液中一定含有SO42-
D
向淀粉-KI溶液中通入少量Cl2
溶液变蓝
Cl2与淀粉发生显色反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质的分类正确的是
选项
碱
酸
盐
碱性氧化物
非电解质
A
NaOH
H2SO4
K2SO4
Na2O
CO2
B
Na2CO3
HC1
NaCI
Na2O
空气
C
KOH
HNO3
CaCO3
CaO
Cu
D
NaOH
HC1
HF
K2O
SO2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. 向FeCl3溶液中加入几滴KSCN溶液:3SCN— + Fe3+ ═Fe(SCN)3 ↓
B. AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2—+4NH4++2H2O
C. 大理石溶于醋酸中的反应:CaCO3+2H+═Ca2++H2O+CO2↑
D. 钠与水反应: 2Na+2H2O═2Na++2OH—+H2↑
难度: 中等查看答案及解析
-
化学与环境保护、工业生产、生活等密切相关,下列说法不正确的是
A. 在食品袋中放入装有硅胶、铁粉的透气小袋,可防止食物受潮、氧化变质
B. 因SO2具有氧化性,故可用于漂白纸浆
C. 新版人民币用于人民币票面文字等处的油墨中所含有的Fe3O4是一种磁性物质
D. 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的原料
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 摩尔是一个物理量 B. 18 g水中含有1 mol H2O
C. 硫酸的摩尔质量是98 g D. 物质的量就是物质的粒子数目
难度: 中等查看答案及解析
-
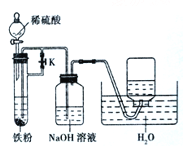
下列实验能达到实验目的且符合安全要求的是( )
A. 制备氢氧化亚铁并观察其颜色
 B. 观察钾离子的焰色反应
B. 观察钾离子的焰色反应 C. 制备并检验氢气的可燃性
C. 制备并检验氢气的可燃性 D. 浓硫酸稀释
D. 浓硫酸稀释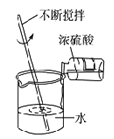
难度: 困难查看答案及解析
-
为除去括号内的杂质,所选用的试剂或方法错误的是
A. FeCl2溶液(FeCl3):加入过量铁粉,过滤
B. NaHCO3溶液(Na2CO3):通入过量的CO2气体
C. NaNO3溶液(Na2SO4):加入适量的BaCl2液
D. MgO固体(Al2O3):加入过量的NaOH溶液,过滤
难度: 中等查看答案及解析
-
已知NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 27g Al与NaOH完全反应,转移的电子数为0.1NA
B. 1L 1mol/L CaC12溶液中含有的Cl-离子数目为NA
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
难度: 中等查看答案及解析
-
在一定温度和压强下,5 L气体A2跟10 L气体B2化合生成10 L某气体C,则气体C化学式为( )
A. A2B B. AB2 C. AB3 D. AB
难度: 中等查看答案及解析
-
下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向石灰水中逐渐通入CO2直至过量
②向CaCl2溶液中逐渐通入SO2直至过量
③向Ba(OH)2溶液中逐滴加入稀硫酸直至过量
④向Fe(OH)3胶体中逐滴加入稀盐酸直至过量
A. ①②③ B. ①④ C. ①②④ D. ②③④
难度: 中等查看答案及解析
-
把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平)。下列说法正确的是
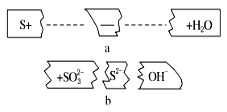
A. 反应物微粒是S、SO32-、OH-
B. 该反应可能在酸性条件下进行
C. 氧化剂与还原剂的物质的量之比为2∶1
D. 2 mol S参加反应时,转移的电子数为3NA
难度: 中等查看答案及解析
-
向含Fe2+、I−、Br−的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b−a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是
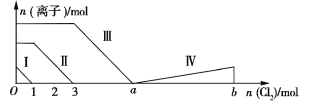
A. 线段Ⅱ表示Br−的变化情况
B. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
C. 根据图象无法计算a的值
D. 线段Ⅳ表示
的变化情况
难度: 中等查看答案及解析
-
下列有关Na2CO3和NaHCO3的说法中,正确的是
A. 热稳定性:Na2CO3<NaHCO3
B. 相同温度下在水中的溶解度:Na2CO3<NaHCO3
C. 取1 mol·L-1的两种溶液,分别滴加澄清石灰水,有沉淀生成的是Na2CO3溶液
D. 取等质量的两种固体分别与等浓度等体积的盐酸反应,生成气泡较快的是NaHCO3溶液
难度: 中等查看答案及解析
-
有两种金属粉末的混合物15.6g,投入足量的稀硫酸中充分反应,产生5.6 L标准状况时的氢气,此混合物不可能是( )
A. Fe和Zn B. Al和Zn C. Fe和Cu D. Mg和Al
难度: 中等查看答案及解析
-
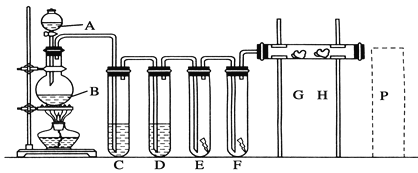
如图所示,A处通入Cl2,关闭B阀时,C处湿润的红色布条无变化;
打开B阀时,C处湿润的红色布条褪色,则D中的溶液是 ( )
A. 浓H2SO4 B. H2O
C. NaOH溶液 D. 饱和食盐水
难度: 困难查看答案及解析
-
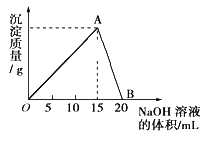
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是( )
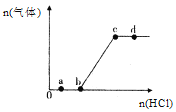
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:H+、Fe3+、MnO4-、Cl-
C. d点对应的溶液中:S2-、NO3-、Fe2+、Ag+
D. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
难度: 中等查看答案及解析