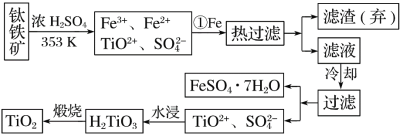
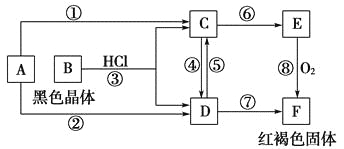
-
用铝箔包住0.1 mol的金属钠,用针在铝箔上扎出一些小孔,放入水中,完全反应后,用排水集气法收集产生的气体,则收集到的气体为(标准状况)
A. O2和H2的混合气体 B. 1.12 L的H2
C. 大于1.12 L的H2 D. 小于1.12 L的气体
难度: 中等查看答案及解析
-
下列关于铝的叙述不正确的是
A. 铝是地壳中含量最多的元素
B. 在常温下,铝能与NaOH溶液反应
C. 铝是一种比较活泼的金属
D. 在化学反应中,铝容易失去电子,是还原剂
难度: 中等查看答案及解析
-
把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是
A. 3∶8 B. 8∶3
C. 3∶4 D. 4∶3
难度: 中等查看答案及解析
-
有关铝及其化合物的说法错误的是
A. 铁易生锈,而铝在空气中较稳定,所以铁比铝活泼
B. 可用铝壶烧开水,不可用其长期存放食醋、碱水
C. 氧化铝是一种较好的耐火材料,但不可用氧化铝坩埚熔化NaOH
D. 氢氧化铝能中和胃酸,可用于制胃药
难度: 中等查看答案及解析
-
准确称取6.0 g铝土矿样品(含Fe2O3),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为
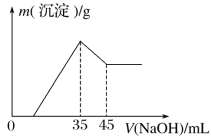
A. 1.75 mol·L-1 B. 3.5 mol·L-1
C. 0.85 mol·L-1 D. 无法确定
难度: 中等查看答案及解析
-
从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下图表示了三种金属被人类开发利用的大致年限。之所以有先后。主要取决于( )

A. 金属的导电性强弱 B. 金属在地壳中的含量多少
C. 金属的化合价高低 D. 金属的活动性强弱
难度: 中等查看答案及解析
-
用一定量的铁与足量的稀硫酸及足量的CuO反应制单质铜,有人设计了以下两种方案:①Fe
H2
Cu ②CuO
CuSO4
Cu,若按实验原理进行操作,则两者制得单质铜的量
A. 一样多 B. ①多
C. ②多 D. 无法判断
难度: 中等查看答案及解析
-
在高温下用一氧化碳还原m g四氧化三铁得到n g铁。已知氧的相对原子质量为16,则铁的相对原子质量为
A. 21n/(m-n) B. 64n/(3m-3n)
C. (m-n)/32n D. 24n/(m-n)
难度: 中等查看答案及解析
-
用足量的CO还原32.0 g某种氧化物,将生成的气体通入足量澄清石灰水中,得到60 g沉淀,则该氧化物是
A. FeO B. Fe2O3 C. CuO D. Cu2O
难度: 中等查看答案及解析
-
有关铁的氧化物的说法中,不正确的是
A. 赤铁矿的主要成分是Fe2O3,Fe2O3是红棕色的,常用作红色油漆和涂料
B. Fe3O4是黑色晶体,其中1/3的铁显+2价,2/3的铁显+3价
C. FeO、Fe2O3、Fe3O4都不溶于水,但都能和盐酸反应生成相应的盐
D. FeO不稳定,在空气中加热迅速被氧化成Fe2O3
难度: 中等查看答案及解析
-
a g钠、铝的混合物,放入b g水中,反应停止后得到的沉淀有c g,则溶液中溶质为( )
A. NaOH B. NaAlO2 C. NaOH和NaAlO2 D. 无法确定
难度: 简单查看答案及解析
-
Mg、Al混合物与足量盐酸反应,产生标况下的氢气4.48 L,下列说法不正确的是
A. 参加反应的Mg、Al共0.2 mol B. 参加反应的HCl为0.4 mol
C. Mg、Al在反应中共失去0.4 mol电子 D. 若与足量的稀硫酸反应能产生0.2 mol H2
难度: 困难查看答案及解析
-
等量镁铝合金粉末分别投入到下列四种过量物质的溶液中,充分反应,放出H2最多的是
A. NaOH溶液 B. 稀H2SO4溶液
C. 蔗糖溶液 D. NaCl溶液
难度: 中等查看答案及解析
-
铝分别与足量的稀硫酸和氢氧化钠溶液反应,当两个反应放出的气体在相同的状况下体积相等时,反应中消耗的硫酸和氢氧化钠物质的量之比为( )
A. 1:4 B. 2:3 C. 3:2 D. 4:1
难度: 中等查看答案及解析
-
单晶硅是制作电子集成电路的基础材料。用化学方法可制得高纯度硅,其化学方程式为:
①SiO2+2C
Si+2CO↑ ②Si+2Cl2
SiCl4
③SiCl4+2H2
Si+4HCl。
下列对上述三个反应的叙述中,不正确的是
A. ①③为置换反应
B. ②为化合反应
C. ①②③均为氧化还原反应
D. 三个反应的反应物中硅元素均被还原
难度: 中等查看答案及解析
-
将少量CO2气体通入水玻璃中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体物质是
A. Na2SiO3 B. Na2CO3、Na2SiO3
C. Na2CO3、SiO2 D. SiO2
难度: 中等查看答案及解析