-
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是
A. 未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B. 加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C. 加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D. 加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
难度: 中等查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-1
已知:①碳的燃烧热△H1=akJ·mol-1
②S(s)+2K(s)==K2S(s) △H2=bkJ·mol-1
③2K(s)+N2(g)+3O2(g)==2KNO3(s) △H3=ckJ·mol-1 。则x为:
A. 3a+b-c B. c+3a-b C. a+b-c D. c+a-b
难度: 简单查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度②升高温度③增大压强④移去生成物⑤加入催化剂
A. ②⑤ B. ①②③⑤ C. ①②③ D. ①②③④⑤
难度: 简单查看答案及解析
-
在密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B)=3 v (A), 3 v (C)=2 v (B)。 则此反应可表示为( )
A. 2A + 3B = 2C B. A+ 3B = 2C
C. 3A + B = 2C D. A + B = C
难度: 简单查看答案及解析
-
能源可划分为一级能源和二级能源,自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取;未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列叙述正确的是( )
A. 水煤气,电能是一级能源
B. 天然气,水力是二级能源
C. 核能,煤,石油符合未来新能源标准
D. 太阳能,生物质能,风能,氢能符合未来新能源标准
难度: 简单查看答案及解析
-
下列关于电解质说法正确的是( )
A. SO2、CO2溶于水能导电,但SO2、CO2都是非电解质
B. 盐酸能导电,所以盐酸是电解质
C. 强电解质溶液导电能力比弱电解质导电能力强
D. 离子化合物都是强电解质,共价化合物都是弱电解质
难度: 简单查看答案及解析
-
下列关于ΔH(焓变)的说法正确的是( )
A. 在恒压件下,化学反应的焓变等于化学反应的反应热
B. ΔH>0时,反应放出热量;ΔH<0时,反应吸收热量
C. 需要加热才能发生的反应一定是吸热反应
D. 任何放热反应在常温下一定能发生反应
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A. 双氧水受热分解
B. Ba(OH)2·8H2O晶体与NH4Cl晶体的反应
C. 灼热的木炭与二氧化碳化合
D. 甲烷在空气中燃烧的反应
难度: 中等查看答案及解析
-
已知常温下浓度均为0.1 mol·L-1的下列溶液的pH如表:
溶质
NaF
Na2CO3
NaClO
NaHCO3
pH
8.1
11.6
9.7
8.4
下列有关说法正确的是( )
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C. 若将少量CO2通入NaClO溶液至溶液中,离子方程式为:ClO-+CO2+H2O=HClO+CO32-
D. 向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF = CO2+H2O+2NaF
难度: 中等查看答案及解析
-
下列反应中,熵显著减少的反应是 ( )
A. CO(g)+2H2(g)= CH3OH(g)
B. CaCO3(s)+2HCl(aq)= CaCl2(aq)+CO2(g)+H2O(l)
C. (NH4)2CO3(s)= NH4HCO3(s)+NH3(g)
D. 2HgO(s)= 2Hg(l)+O2(g)
难度: 中等查看答案及解析
-
(6分)(2012•重庆)下列叙述正确的是( )
A. 盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B. 稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C. 饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D. 沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
难度: 中等查看答案及解析
-
已知下列反应的平衡常数: H2(g)+S(s)
H2S(g) K1 S(s)+O2(g)
SO2(g) K2则反应H2+SO2
O2+H2S的平衡常数为( )
A. K1+K2 B. K1-K2
C. K1×K2 D. K1/K2
难度: 中等查看答案及解析
-
说明氨水是弱碱的事实是: ( )
A. 氨水具有挥发性。 B. 1mol/L氨水溶液1升可以与1molHCl完全反应
C. 1mol/L NH4Cl溶液的pH=5 D. 氨水与AlCl3溶液反应生成Al(OH)3沉淀
难度: 中等查看答案及解析
-
已知:C(s)+O2(g)= CO2(g) ΔH=-393.5 kJ·mol-1 2H2(g)+O2(g)= 2H2O(g) ΔH=-483.6 kJ·mol-1,现有0.2 mol的炭粉和氢气组成的悬浮气,此混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为( )
A. 1∶1 B. 1∶2 C. 2∶3 D. 3∶2
难度: 简单查看答案及解析
-
在酸碱中和滴定实验时,盐酸为标准液,NaOH溶液为待测液,下列操作会导致待测液浓度偏大的是
A. 用碱式滴定管量取待测液时俯视刻度线(开始调液面时读数正确)
B. 未用待测液润洗锥形瓶
C. 滴定结束后俯视刻度线
D. 滴定结束后,酸式滴定管尖嘴部分有气泡
难度: 中等查看答案及解析
-
下列离子在指定条件下一定能大量共存的一组是:( )
A. c(H+)/c(OH—)=105的溶液中:Na+、ClO-、K+、Cl-
B. 由水电离出的C(H+)=1×10-13mol/L的溶液中:NH4+、Fe2+、Cl-、SO42-
C. 使酚酞变红色的溶液中:NO3-、Cl-、Ca2+、Na+
D. 使甲基橙变红色的溶液中:NO3-、Al3+、NH4+、SO42-
难度: 中等查看答案及解析
-
已知在25℃时,AgCl的Ksp为1.8×10-10,Ag2S的Ksp为6.3×10-50,将AgCl与Ag2S的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A. 只有Ag2S沉淀生成 B. AgCl和Ag2S等物质的量生成
C. AgCl沉淀多于Ag2S沉淀 D. Ag2S沉淀多于AgCl沉淀
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是:( )
A. pH=3的盐酸和pH=11的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-)
B. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+ c(OH-)
C. pH=8.3的NaHCO3溶液c(Na+)>c(HCO3-)> c(H2CO3) > c(CO32-)
D. 0.2mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合:2c(H+)—c(OH-)=c(CH3COO-)—c(CH3COOH)
难度: 中等查看答案及解析
-
某温度下,将2mol A和3mol B充入一密闭容器中,发生反应:aA(g)+ B(g)
C(g)+ D(g),5min后达到平衡。已知该温度下其平衡常数为1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )

A. a=2
B. 达到平衡时A的转化率为60%
C. 速率随时间变化关系如图所示
D. 为提高A的转化率,可采取升高温度的措施
难度: 中等查看答案及解析
-
室温下,将等浓度等体积的弱酸HA和HB与NaHCO3反应放出CO2的体积与时间的关系如图所示,则以下说法错误的是:( )
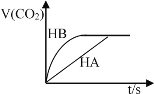
A. 酸性:HA<HB
B. pH均为4的HA和HB溶液中和等量NaOH时,所需HA溶液体积小
C. pH均为9的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
D. 浓度均为0.1mol/L的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
难度: 中等查看答案及解析