-
“一带路(OneBelt AndOneRoad)”构建人类命运共同体,符合国际社会的根本利益,彰显著人类社会的共同理想和关好追求。下列贸易的商品中,其主要成分属于无机物的是( )
A. 捷克水晶 B. 埃及长绒棉 C. 乌克兰葵花籽油 D. 中国丝绸
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值。下列说法正确的是( )
A. 密闭容器中,2 mol SO2 和足量 O2 充分反应,产物的分子数为 2 NA
B. 含 NA个 CO32-的 Na2CO3 溶液中,Na+数目为 2 NA
C. 11.2 L 甲烷和乙烯的混合物中含氢原子数目为 2 NA
D. 4.0 g CO2 气体中含电子数目为 2 NA
难度: 中等查看答案及解析
-
二羟甲戊酸是生物合成青蒿素的原料之一,其结构如图所示。下列关于二羟甲戊酸的说法正确的是
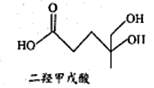
A. 分子式为C3H14O4
B. 能使酸性KMnO4溶液褪色
C. 能发生加成反应,不能发生取代反应
D. 1mol该有机物与足量金属钠反应产生22.4L H2
难度: 中等查看答案及解析
-
四种短周期元素X、Y、Z、W在周期表中的位置如图所示,其中Z元素的最外层电子数是内层电子总数的1/2。下列说法不正确的是( )
A. Z元素位于周期表的第三周期第VA族
B. X、W元素的最高价氧化物对应水化物的酸性:W强于X
C. Y元素的气态氢化物的热稳定性比Z的高
D. X与W形成共价化合物XW2, X的原子半径比Y小
难度: 中等查看答案及解析
-
由下列实验操作及现象能得出相应结论的是
操作
现象
结论
A.
将蘸有浓氨水的玻璃棒靠近某溶液
有白烟产生
该溶液一定为浓盐酸
B.
向 CH3COONa 溶液中滴入酚酞试液,加热
加热后红色加深
CH3COONa 水解是吸热反应
C.
向某溶液中加入盐酸,将产生
的气体通入澄清石灰水
澄清石灰水变浑浊
该溶液中一定有 CO32—
D.
向 NaCl 溶液中滴加过量
AgNO3 溶液,再滴加 KI 溶液
先出现白色沉淀, 后出现黄色沉淀
Ksp(AgI) < Ksp(AgCl)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
以酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是( )

A. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B. a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
C. 电解过程中SO42— 移向b极
D. a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 中等查看答案及解析
-
常温下,用 0.1000mol·L-1 NaOH溶液滴定 20.00mL0.1000mol·L-1某一元酸HA溶液,滴定曲线如图。下列说法正确的是( )
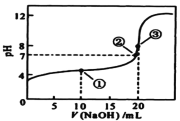
A. HA是强电解质
B. 点①所示溶液中:c(A-) >c(Na+)>c(H+) >c(OH-)
C. 点②所示溶液中:c(Na+) =c(HA) +c(A-)
D. 水的电离程度随着NaOH溶液的滴入,不断增大
难度: 中等查看答案及解析
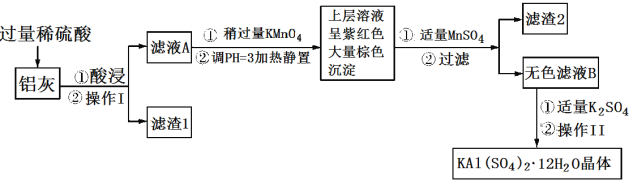

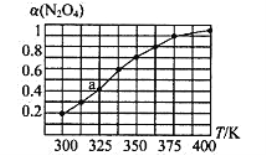

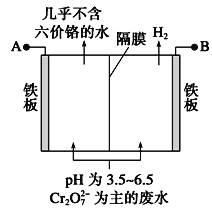


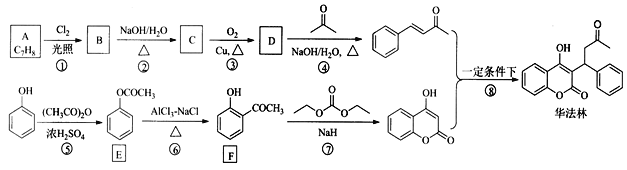
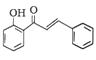 的合成路线(其他无机试剂任选)。________________
的合成路线(其他无机试剂任选)。________________