-
2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是:( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 简单查看答案及解析
-
下列有关溶液配制的说法正确的是
A. 在50mL量筒中配制0.1000mol•L﹣1碳酸钠溶液
B. 仅用烧杯、量筒、玻璃棒就可以配制100mL0.1000mol•L﹣1K2Cr2O7溶液
C. 用100mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100mLpH=2的盐酸
D. 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的是
A. 22.4LCO2与CO的混合气体中含碳原子数为NA
B. 常温下, 1L0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2 NA
C. 2.7g金属铝变为铝离子时失去的电子数目为0.3NA
D. 室温下,21.0 gC2H4和C4H8的混合气体中含有的原子数目为4.5 NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B. 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C. 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D. 物质的溶解度都随温度的升高而增加,物质的溶解都是吸热的
难度: 简单查看答案及解析
-
将NO3-+Zn+OH-+H2O → NH3+Zn(OH)42- 配平后,离子方程式中H2O的系数是
A. 2 B. 4 C. 6 D. 8
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ===2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是
A. Na2O2只作氧化剂
B. 2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C. 每生成22.4L氧气就有2 mol Fe2+ 被氧化
D. Na2FeO4既是还原产物又是氧化产物
难度: 困难查看答案及解析
-
用0.1mol/LNa2SO3溶液20mL,恰好将1.0×10-3molXO4-还原,则X元素在反应后所得还原产物中化合价为
A. +3价 B. +2价 C. +1价 D. 0价
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 漂白粉、水玻璃、冰醋酸都是混合物
B. 金属氧化物一定是碱性氧化物
C. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D. 氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 漂白粉溶液中通入过量的CO2: Ca2++2ClO-+ CO2+ H2O = CaCO3↓+2HClO
B. 氯气与水的反应: Cl2+H2O
2H++Cl-+ClO—
C. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3—+Ba2++OH-=BaCO3↓+H2O
D. 钠和冷水反应 : Na+2H2O=Na++2OH-+H2↑
难度: 困难查看答案及解析
-
能实现下列物质间直接转化的元素是( )

A. 硅 B. 硫 C. 铜 D. 铁
难度: 中等查看答案及解析
-
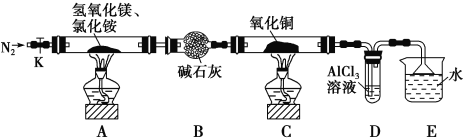
已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中正确的是
A. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B. A、B、C中有一种金属且为B
C. 如果E溶液是一种强酸,则E溶液为硫酸
D. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱
难度: 困难查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是
A. 4 v(NH3)=5v(O2) B. 5 v(O2)=6v(H2O)
C. 2 v(NH3)=3v(H2O) D. 4 v(O2)=5v(NO)
难度: 中等查看答案及解析
-
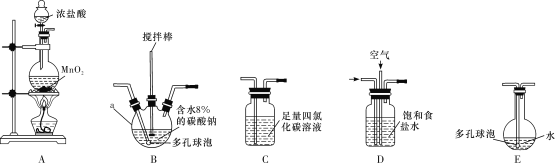
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )。
A.
B.
C.
D.
难度: 简单查看答案及解析
-
实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
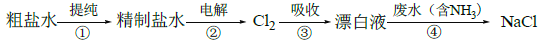
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
难度: 中等查看答案及解析
-
进行下列实验,相关说法正确的是
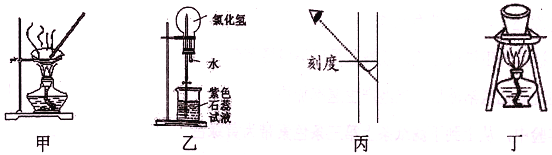
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
难度: 困难查看答案及解析
-
10 mL一定物质的量浓度的盐酸被一定物质的量浓度的NaOH溶液滴定的图示如下图,据图推出NaOH溶液和盐酸的物质的量浓度正确的是
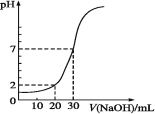
A
B
C
D
c(HCl)
0.12
0.04
0.12
0.09
c(NaOH)
0.04
0.12
0.06
0.03
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
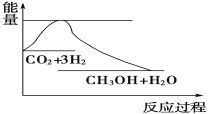
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
难度: 中等查看答案及解析
-
若往20 mL 0.01 mol·L-1 HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图所示。下列有关说法不正确的是
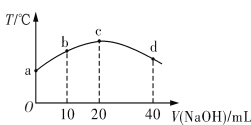
A. HNO2的电离平衡常数:c点>b点
B. b点混合溶液显酸性:c(Na+)>c(NO2-)>c(H+)>c(OH-)
C. c点混合溶液中:c(OH-)>c(HNO2)
D. d点混合溶液中:c(Na+)>c(OH-)>c(NO2-)>c(H+)
难度: 困难查看答案及解析
-
某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
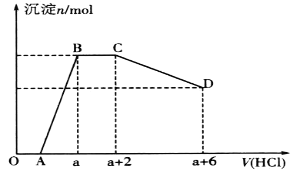
A. BC段是OH-与盐酸反应
B. 反应后最终溶液中的溶质只有NaC1
C. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D. 原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
难度: 困难查看答案及解析
-
下列各项操作或现象能达到预期实验目的的是
选项
操作或现象
实验目的
A
将铁钉放入试管中,用盐酸浸没
验证铁的吸氧腐蚀
B
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色
证明Br—还原性强于Cl—
C
将氯化亚铁固体溶于适量蒸馏水中
配制FeCl2溶液
D
将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶
除去氯气中的HCl气体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
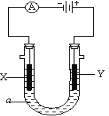
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
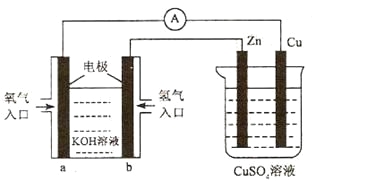
A. 该装置中Cu极为正极
B. 当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C. b极反应的电极反应式为:H2-2e-=2H+
D. 一段时间后锌片质量减少
难度: 中等查看答案及解析
-
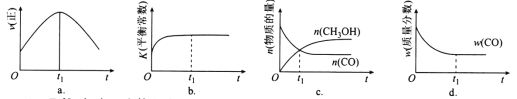
臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A
B
C
D
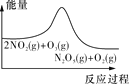
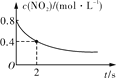
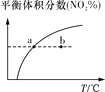
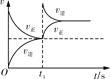
平衡后升温,NO2含量降低
0~2 s内,v(O3)=0.2 mol·L-1·s-1
v正:b点>a点
b点:v逆>v正
恒温,t1时再充入O3
A. A B. B C. C D. D
难度: 困难查看答案及解析