-
某无色溶液X可能含有:K+、Na+、 NH4+、 Mg2+ 、Ba2+ 、HCO3—、Cl—、SO42—中若干种,且离子浓度相同,为确定其组成,依次进行下列实验。①取少量溶液X,向其中加入足量的氢氧化钠溶液,有白色沉淀A产生;微热,闻到刺激性气味。②过滤上述混合物,在滤液中加入足量的氯化钡溶液,有白色沉淀B产生,再加入足量的稀硝酸,沉淀不溶解。根据上述实验,以下说法正确的是
A. 溶液X —定含有NH4+、Mg2+、SO42—可能含有HCO3—
B. 溶液X中一定没有HCO3—,但不能确定是否含有Cl—
C. 溶液X中是否含有Na+、K+需要通过焰色反应确定
D. 白色沉淀A和白色沉淀B都是纯净物
难度: 中等查看答案及解析
-
化学与生活密切相关。下列说法中错误的是
A. “酸可以除锈” “洗涤剂可以去油污”都是发生了化学反应
B. 蚊虫叮咬处感到疼痛是有甲酸注入人体的缘故,涂肥皂水可减轻疼痛是利用其弱碱性
C. 月饼包装盒中的铁粉可以起到抗氧化作用
D. 利用明矾净水,可以达到沉淀悬浮物的目的
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
A. 核内质子数为117、中子数为174的核素Ts可表示为:
B. 甲烷分子的比例模型:
C. COCl2的结构式为:
D. H2O2的电子式为:H+[
]2-H+
难度: 简单查看答案及解析
-
从物质分类的角度进行下列判断,正确的是( )
A.根据是否具有丁达尔效应,可将分散系分为溶液、浊液和胶体
B.SiO2既能与NaOH溶液反应,又能与氢氟酸反应,但SiO2不属于两性氧化物
C.AgCl的水溶液不易导电,故AgCl是弱电解质
D.烧碱、纯碱、熟石灰均属于碱
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数值,下列叙述中正确的是
A. 6g SiO2晶体中含有Si-O键的数目为0.2NA
B. 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA
C. 18gH218O和2H2O的混合物中,所含中子数为9NA
D. 25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0.1NA
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 硫化亚铁与稀硝酸混合反应:2H++FeS=H2S↑+ Fe2+
B. 酸化NaIO3和NaI的混合溶液,滴入几滴淀粉溶液变蓝色:5I− +IO3−+6H+
3I2+3H2O
C. Ba(OH)2与等物质的量 NaHSO4混合:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
D. 电解饱和食盐水:2Cl−+2H+
Cl2↑+ H2↑
难度: 中等查看答案及解析
-
短周期元素A、B、C在周期表所处的位置如图所示。A、B、C三种元素原子的质子数之和为32。E与B形成的化合物E2B是离子化合物。则下列说法正确的是
A
C
B
A. 四种元素形成的简单离子中,E离子的半径最大
B. A、B、C元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. C离子的还原性比B离子的还原性强
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应。
难度: 困难查看答案及解析
-
实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 pH=5时沉淀完全).其中分析错误的是
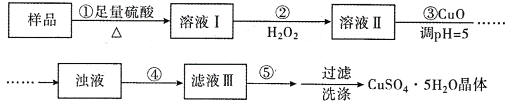
A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②不能用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤④为过滤,步骤⑤蒸发结晶
难度: 中等查看答案及解析
-
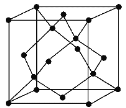
已知Al2H6燃烧热极高,是一种很好的生氢剂,它跟水反应生成H2,球棍模型如图(白球为Al,黑球为H)。下列推测肯定不正确的是
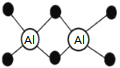
A. 该物质与水反应,属于氧化还原反应
B. Al2H6分子中氢为+1价,铝为﹣3价
C. Al2H6在空气中完全燃烧,产物为氧化铝和水
D. 氢铝化合物可能成为未来的储氢材料和火箭燃料
难度: 中等查看答案及解析
-
下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
选项
X
Y
Z
对应过程的反应条件
A
SiO2
Na2SiO3
H2SiO3
①Na2CO3熔融
B
NaOH
NaHCO3
Na2CO3
②加热
C
N2
NO2
HNO3
③加热
D
C
CO
CO2
④灼热炭粉
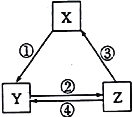
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列说法正确的是
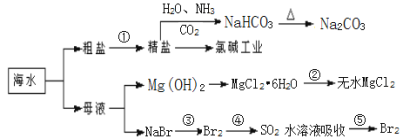
A. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除SO42-后除Ca2+
B. 过程中②是将MgCl2·6H2O在空气中受热脱水得到无水MgCl2
C. 在③、④、⑤中,溴元素均被氧化
D. 可用澄清石灰水检验Na2CO3和NaHCO3
难度: 中等查看答案及解析
-
下列各实验操作、现象和结论描述有错误的是
选项
实验操作和现象
结论
A
常温下,测定同浓度NaA和NaB溶液的pH:NaA小于NaB
相同条件下,在水中HA电离程度大于HB
B
常温下,用pH试纸测得新制氯水的pH约为4
常温下新制氯水显酸性
C
将硫的酒精溶液滴入一定量的热水中得淡蓝色透明液体,用激光笔照射,有光亮的通路
淡蓝色液体属于胶体
D
向X溶液中滴入浓NaOH溶液,加热,将湿润的红色石蕊试纸置于试管口,试纸变蓝
X溶液中一定有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是
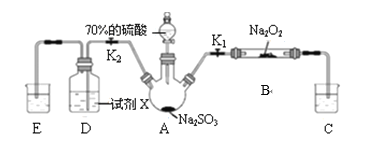
A. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
B. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗1mol Na2O2,转移1mol电子
C. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
难度: 中等查看答案及解析
-
将打磨后的镁条放入盛有50ml蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图。下列有关描述正确的
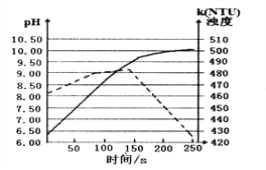
A. 该实验是在常温下进行的
B. 实线表示溶液浊度随时间的变化
C. 50s时向溶液中滴入酚酞试液,溶液变红
D. 150s后溶液浊度下降是因为生成的Mg(OH)2沉降
难度: 困难查看答案及解析
-
将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol • L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
难度: 中等查看答案及解析
-
当今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)
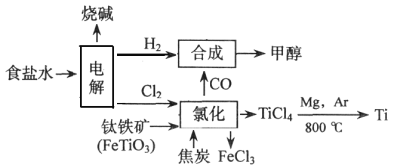
下列叙述正确的是
A. 该流程中只有“电解”、“氯化”涉及氧化还原反应
B. “氯化”时每消耗36g焦炭,则转移7mol电子
C. “合成”反应中氧化剂与还原剂的物质的量之比为1:1
D. 上述流程中“Mg,Ar"可用“Mg,CO2”代替
难度: 困难查看答案及解析
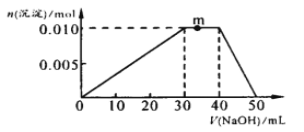
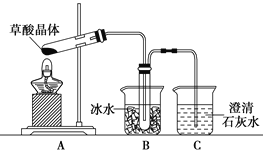
 ___H2C2O4+9NO2↑+3NO↑+_______ ______
___H2C2O4+9NO2↑+3NO↑+_______ ______