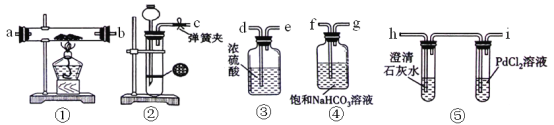
-
下列物质只含有离子键的是( )
A. Br2 B. CO2 C. KCl D. NaOH
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 化学反应中的能量变化都表现为热量的变化
B. 需要加热才能发生的反应一定是吸热反应
C. 放热反应在常温下一定很容易发生
D. 反应物的总能量高于生成物的总能量的反应是放热反应
难度: 简单查看答案及解析
-
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A. 海水中含有钾元素,只需经过物理变化就可以得到钾单质
B. 海水制盐的过程中只发生了化学变化
C. 从海水中可以得到NaCl,电解熔融NaCl可制备Na
D. 利用潮汐发电是将化学能转化为电能
难度: 简单查看答案及解析
-
“酸雨”的形成主要是由于( )
A. 森林遭乱砍滥伐,破坏了生态平衡 B. 工业上大量燃烧含硫燃料
C. 大气中二氧化碳的含量增多 D. 汽车排出大量尾气
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A. 32 g O2占有的体积约为22.4 L
B. 22.4 L N2含阿伏加德罗常数个氮分子
C. 在标准状况下,22.4 L水的质量约为18 g
D. 22 g二氧化碳与标准状况下11.2 L HCl含有相同的分子数
难度: 简单查看答案及解析
-
将一小块金属钠长期露置于空气中发生一系列变化,最终产物是
A. NaOH B. Na2O C. Na2O2 D. Na2CO3
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 固体氯化钠不导电,所以氯化钠是非电解质
B. 铜丝能导电,所以铜是电解质
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. CO2溶于水能导电,所以CO2是电解质
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 钠和冷水反应:Na +2H2O=Na++2OH-+H2↑
B. 金属铝溶于氢氧化钠溶液:Al +2OH-=AlO2-+ H2↑
C. 金属铝溶于盐酸:2Al+6H+=2Al3++3H2↑
D. 铁和稀硫酸反应:Fe+2H+=Fe3++H2↑
难度: 简单查看答案及解析
-
下列各组物质混合后,既有气体生成,最终又有沉淀生成的是
①金属钠投入到FeCl3溶液
②过量NaOH溶液和明矾溶液
③过量生石灰投入到少量饱和NH4HCO3溶液
④Na2O2投入FeCl2溶液
A. 只有① B. 只有③ C. 只有②③ D. 只有①③④
难度: 中等查看答案及解析
-
关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
难度: 中等查看答案及解析
-
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O
2HI+H2SO4
②2FeCl3+2HI
2FeCl2+2HCl+I2
③3FeCl2+4HNO3
2FeCl+NO+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+>NO B. I->Fe2+>H2SO3>NO C. Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3>I-
难度: 中等查看答案及解析
-
下列实验现象与氧化还原反应有关的是
A. NH3使湿润的红色石蕊试纸变蓝
B. 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成
C. 将NO2通入水中,气体由红棕色逐渐转变为无色
D. 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀
难度: 中等查看答案及解析
-
水溶液中能大量共存的一组离子是
A. Na+、Ca2+、Cl-、SO42-
B. Fe2+、H+ 、SO32-、ClO-
C. Mg2+、NH4+、Cl-、SO42-
D. K+、Fe3+、NO3-、SCN-
难度: 简单查看答案及解析
-
下列有关物质性质和用途都正确,且有对应关系的是( )
A. SiO2能导电,可用于制造光导纤维 B. 金属Al硬度大,是良好的建筑材料
C. NH3易溶于水,可用作制冷剂 D. 浓硫酸有强氧化性,常温下可使铁钝化,所以可用钢制容器储存、运输
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种高效的净水剂,可用次氯酸盐氧化法制备,原理如下:
①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4+2KOH=K2FeO4+2NaOH.下列说法不正确的是( )
A. 反应①为氧化还原反应,反应②为复分解反应 B. 反应①中Na2FeO4是氧化产物
C. 反应①中氧化剂和还原剂的物质的量之比为2:3 D. 每生成1mol K2FeO4,转移电子的物质的量为3mol
难度: 中等查看答案及解析
-
Na2O2是呼吸面具中常用的供氧剂,下列关于Na2O2的叙述正确的是( )
A. Na2O2中阴、阳离子的个数比为1:1
B. Na2O2分别与水、CO2反应,产生相同量的O2时,需要水和CO2的物质的量相等
C. Na2O2与CO2反应过程中,只做氧化剂
D. Na2O2与SO2的漂白原理相同
难度: 中等查看答案及解析
-
实验室欲用18mol/L的浓硫酸配制500mL 3mol/L的稀硫酸,下列说法正确的是( )
A. 应用量筒量取83.30mL的浓硫酸
B. 在烧杯中溶解后,应立即转移至容量瓶中
C. 加水定容时,若俯视刻度线,会使所配溶液浓度偏低
D. 若未洗涤烧杯内壁并将洗涤液转移至容量瓶中,会使所配溶液浓度偏低
难度: 中等查看答案及解析
-
下列实验现象和结论相符的是( )
操作及现象
结论
A
溶液中加入盐酸,产生使澄清石灰水变浑浊的无色无味气体
溶液中一定含有CO32-
B
某溶液中加入硝酸银,产生白色沉淀
溶液中一定含有Cl-
C
某气体通入澄清石灰水,溶液变浑浊
该气体一定是CO2
D
向某溶液中先加KSCN无明显现象,再滴氯水,溶液变红
溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析