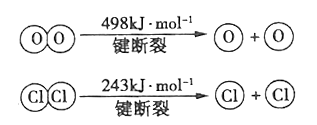
-
2010年4月中旬全球核安全峰会在华盛顿举行,发展核电、制裁核武器发展是会议主题,各式各样电池的发展是化学对人类的一项重大贡献,下列有关电池的叙述正确的是
A.手机上用的锂离子电池属于一次电池
B.锌锰干电池中,锌电极是负极
C.氢氧燃料电池工作时氢气在负极被还原
D.太阳能电池的主要材料为二氧化硅
难度: 中等查看答案及解析
-
2015年4月,于敏获颁“影响世界华人终身成就奖”。“钚一239”是“于敏型”氢弹的重要原料。下列说法正确的是
A. 239Pu原子的原子核中含有239个质子 B. 239Pu衰变成235U属于化学变化
C. 238Pu、239Pu和241Pu属于不同的核素 D. 238Pu与238U在元素周期表中的位置相同
难度: 中等查看答案及解析
-
下列说法错误的是
A. 1H与D互称同位素 B. 氘(D)原子核外有1个电子
C. 1H218O与D216O的相对分子质量相同 D. 14C用于考古时测定文物年代,1H和氘(D)用于制造氢弹
难度: 中等查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是
A. 元素周期表有18个族 B. 元素周期表含元素最多的族是第IIIB族
C. 第I A族的元素全部是金属元素 D. 第五、六周期包含元素种类数目相同
难度: 中等查看答案及解析
-
下列下列说法正确的是
A. F-、Cl-、Br-、I-的还原性逐渐增强 B. HF、HC1、HBr、HI的沸点逐渐升高
C. K可以从NaCl溶液中置换出金属 D. 碱金属单质在空气中燃烧生成的都是过氧化物
难度: 困难查看答案及解析
-
下列叙述中,正确的是
A. 在多电子的原子里,能量高的电子通常在离核近的区域内活动
B. 两种微粒,若核外电子排布完全相同,则其化学性质—定相同
C. 核外电子总是尽可能从内层排起,当一层充满后再填充下一层
D. 微粒的最外层只能是8个电子才稳定
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
W
原子半径/pm
160
143
75
74
主要化合价
+2
+3
+5、+3、-3
-2
下列叙述正确的是()
A. 一定条件下,Z单质与W的常见单质直接生ZW2
B. X、Y元素的金属性:X<Y
C. 一定条件下,W单质可以将Z单质其氢化物中置换出来
D. Y的最高价氧化物对应的水化物能溶于稀氨水
难度: 困难查看答案及解析
-
下列化学用语表示正确的是
A. HC1O的结构式:H-C1-O B. 35Cl-和37C1-离子结构示意图均可以表示为:
C. 氮气的电子式:
D. 氯化铵的电子式:
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子和为21,下列说法一定正确的是
X
Y
Z
W
A. 元素的最高化合价:W>Z>Y
B. X、Y、Z、W中至少有一种是金属元素
C. 一定条件下,W的单质可以置换出Z的单质
D. 简单离子半径由大到小的顺序:W>Z>Y>X
难度: 困难查看答案及解析
-
X、Y代表两种非金属元素,下列不能说明非金属性X比Y强的是
A. X的氧化物的水溶液的酸性比Y的氢化物的水溶液的酸性强
B. Y-的还原性强于X-
C. X的单质X2能将Y的阴离子Y-氧化成Y2
D. X、Y的单质分别与Fe化合,产物中前者Fe为+3价,后者Fe为+2价
难度: 困难查看答案及解析
-
下列有关原子结构、元素性质的说法正确的是
A. 元素原子最外层电子数越多,元素金属性越强
B. 非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
C. Si、P、S、Cl元素的单质与氢气化合越来越容易
D. F﹣、O2﹣、Mg2+、Na+离子半径逐渐减小
难度: 中等查看答案及解析
-
元素X、Y、Z原子序数之和为36,X、Y在同—周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A. 原子半径X>Y,离子半径X+>Z2-
B. 同周期元素中X的金属性最强
C. 同周期元素中Y的最高价含氧酸的酸性最强
D. 同族元素中Z的氢化物稳定性最高
难度: 困难查看答案及解析
-
下列说法正确的是
A. NaF、H2SO4中所含化学键类型相同
B. 氯化铵受热固体消失和千冰升华只需克服分子间作用力
C. I2、Br2、Cl2、F2熔沸点逐渐降低
D. HC1气体溶于水和NaOH熔化破坏的化学键类型相同
难度: 困难查看答案及解析
-
下列说法正确的是
①物质燃烧一定是放热反应②需要加热才能发生的反应一定是吸热反应③放热的化学反应不需要加热就能发生④反应是放出能量还是吸收能量取决于反应物和生成物所具有的总能量的相对大小
A. ③④ B. ①④ C. ②④ D. ②③
难度: 中等查看答案及解析
-
下列说法正确的是
①共价化合物一定含共价键,也可能含离子键②离子化合物一定含离子键,也可能含极性键或非极性键③由非金属元素组成的化合物一定是共价化合物④含金属元素的化合物不一定是离子化合物⑤固态不导电、熔融状态能导电的化合物一定是离子化合物⑥由分子组成的物质中一定存在共价键
A. ②③⑤ B. ①④⑥ C. ②④⑤ D. ①③⑥
难度: 中等查看答案及解析
-
下列叙述中能肯定A金属比B金属活泼性强的是
A. 把A、B金属片用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生
B. 原子的最外层电子数比B原子的最外层电子数少
C. 常温时,A能从水中置换出氢,而B不能
D. lmol A从酸中置换H+生成的H2比lmol B从酸中置换H+生成的H2多
难度: 困难查看答案及解析
-
下列事实不能用元素周期律解释的是
A. Mg、Al与同浓度盐酸反应,Mg更剧烈 B. 向Na2SO3溶液中加盐酸,有气泡产生
C. 0.1 mol·L-1 溶液的碱性:MaOH>LiOH D. 气态氢化物的稳定性:HBr>HI
难度: 困难查看答案及解析
-
下列叙述错误的是
A. 甲烷化学性质比较稳定,不能被任何氧化剂氧化
B. 在通常情况下,甲烷跟强酸、强碱、强氧化剂都不反应
C. 甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHC13,还是CC14,都属于取代反应
D. 甲烷的四种有机取代物都不溶于水
难度: 中等查看答案及解析
-
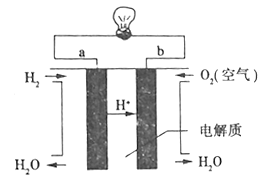
熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是
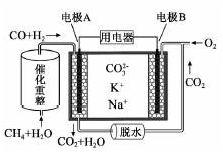
A. 电池工作时,CO32-向电极B移动
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
D. 反应CH4+H2O
3H2+CO,每消耗1mol CH4转移12mol电子
难度: 困难查看答案及解析
-
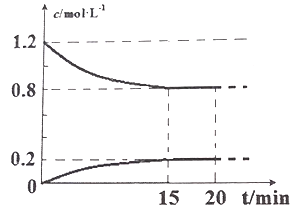
将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)
2C(g), 若经 2 s后测得 C的浓度为 0.6 mol•L-1 ,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 mol•L-1•s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 mol•L-1
其中正确的是
A.①④ B.②③ C.①③ D.③④
难度: 简单查看答案及解析
-
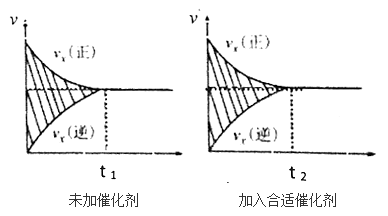
有关化学反应速率的说法正确的是
A. 二催化硫的催化氧化是个放热反应,升高温度,正反应速率减慢
B. 使用催化剂是为了加快反应速率,提高生产效率
C. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生
D. 化学反应达到最大限度时,正逆反应速率相等且也达到最大
难度: 中等查看答案及解析
-
一定温度下,在—定体积的密闭容器中,下列叙述能作为可逆反应A(S)+2B(g)
C(g) +D (g)达到平衡状态标志的是
A. 混合气题的平均分子量不再变化 B. 单位时间内消耗2a mol B,同时生成amol C
C. 2v正(B)=v逆(C) D. 混合气体的总压强不再变化
难度: 中等查看答案及解析
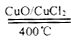 2Cl2+2H2O,可实现氯的循环利用。己知上述反应中,4mol HC1被氧化,放出约116kJ的热量。
2Cl2+2H2O,可实现氯的循环利用。己知上述反应中,4mol HC1被氧化,放出约116kJ的热量。