-
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A.新型材料聚酯纤维、光导纤维都属于有机高分子
B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放
D.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料
难度: 中等查看答案及解析
-
下列表述正确的是
A.中子数为10的氧原子:18 10O
B.Na2S的电子式:
C.聚氯乙烯的结构简式:CH2CHCl
D.Mg5(Si4O10)2(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1 KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/ c (OH—)=10-10的溶液:K+、Ba2+、NO3-、Cl-
C.pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42-
D.c(ClO-)=1.0 mol·L-1的溶液:Na+、SO32-、S2-、SO42-
难度: 中等查看答案及解析
-
实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
A.NaNO2发生氧化反应
B.NH4Cl中的氮元素被还原
C.N2既是氧化产物,又是还原产物
D.每生成1mol N2转移电子的物质的量为6mol
难度: 中等查看答案及解析
-
下列有关物质的性质与应用不相对应的是
A.氢氟酸具有弱酸性,可用于雕刻玻璃
B.MgO、Al2O3熔点高,可用于制作耐火材料
C.ClO2具有强氧化性,可用于自来水的杀菌消毒
D.油脂在碱性条件下易水解,可用于制作肥皂
难度: 中等查看答案及解析
-
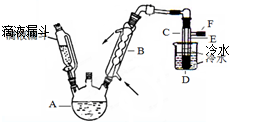
利用下列实验装置进行的相应实验,不能达到实验目的的是
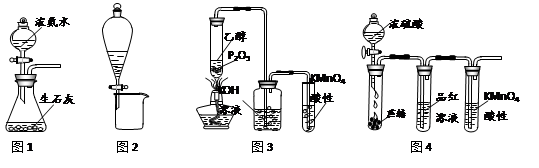
A.用图1所示装置可制取氨气
B.用图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.用图3所示装置可制取乙烯并验证其易被氧化
D.用图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
难度: 中等查看答案及解析
-
下列物质转化在给定条件下能实现的是
①FeS2
SO3
H2SO4
CO2
② Al2O3
NaAlO2(aq)
Al(OH)3
③NaCl(aq)
Na
NaOH(aq)
④Fe
FeSO4(aq)
Fe(OH)2
Fe2O3
⑤
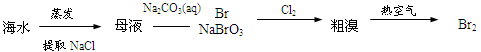
A.①③⑤ B.②③④ C.②④⑤ D.①④⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法一定正确的是
A.25℃,pH=13的NaOH溶液中含有OH-为0.1 NA
B.1 L 0.1 mol·L-1 CuSO4溶液中含有Cu2+为0.1 NA
C.2.24LN2和NH3混合气体中原子间含有的共用电子对数目为0.3NA
D.2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.漂白粉露置在空气中:ClO-+CO2+H2O=HClO+HCO3-
B.用过量氨水吸收二氧化硫:SO2+NH3·H2O=HSO3-+NH4+
C.用足量的氢氧化钠溶液吸收二氧化氮:3NO2+2OH-=2NO3-+NO+H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3+4OH-=2FeO42-+3Cl-+5H2O
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.N2(g)+3H2(g)
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
D.吸热反应“TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0
难度: 中等查看答案及解析
-
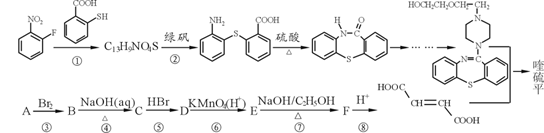
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:
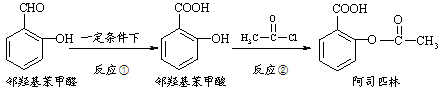
下列说法正确的是
A.邻羟基苯甲醛分子中所有的原子不可能在同一平面
B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
C.反应②中加入适量的NaHCO3可提高阿司匹林的产率
D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3种
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
X
Y
Z
W
A.原子半径:rW>rZ>rY>rX
B.含Y元素的盐溶液有的显酸性,有的显碱性
C.最简单气态氢化物的热稳定性:Z>W
D.X与氢元素组成的化合物XH5与水反应可产生两种气体
难度: 困难查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结 论
A 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 出现白色沉淀 溶液X中一定含有SO42-
B 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 HA放出的氢气多且反应速率快 HB酸性比HA强
C 溴乙烷与NaOH溶液共热后,滴加AgNO3溶液 未出现淡黄色沉淀 溴乙烷未发生水解
D 向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物Y,加热 未出现砖红色沉淀 Y中不含有醛基
难度: 中等查看答案及解析
-
下列有关物质浓度关系的描述中,正确的是
A.25℃时,NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol·L-1
B.25℃时,向0.1mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(NH4+)>c(SO42—)>c(OH—)=c(H+)
C.0.1 mol·L-1的NaHCO3溶液中:c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)
D.同温下,pH相同时,溶液物质的量浓度:
c(CH3COONa)>c(NaHCO3)>c(C6H5ONa)>c(Na2CO3)
难度: 困难查看答案及解析
-
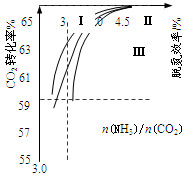
900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
ΔH=a kJ·mol—1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/min
0
10
20
30
40
n(乙苯)/mol
0.40
0.30
0.24
n2
n3
n(苯乙烯)/mol
0.00
0.10
n1
0.20
0.20
下列说法正确的是
A.反应在前20 min的平均速率为v(H2)=0.008mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆
难度: 困难查看答案及解析