-
隆冬季节,雾霾天气增多造成一些城市空气重度污染,其中的污染物不包括
A. PM2.5 B. NO2 C. SO2 D. CO2
难度: 中等查看答案及解析
-
苯胺是染料工业的重要原料,因其毒性强,在环境中对苯胺类化合物应严格控制排放。下 列关于苯胺(C6H5NH2)结构和性质的说法中不正确的是
A. 碳原子和氮原子均采取Sp2杂化 B. 分子中既有
键又有
键
C. 能发生加成反应和取代反应 D. 既能与盐酸反应,又能被氧化
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.
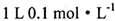 的NH4NO3溶液中氮原子数小于0.2NA
的NH4NO3溶液中氮原子数小于0.2NAB. 某温度时,1LpH=6的纯水中含有1.0X10-6NA个OH-
C. 在O2参加的反应中,1mol O2作氧化剂时得到的电子数一定是4NA
D. 向含有0.4 mol FeBr2的溶液中通入0.3 mol Cl2,充
分反应时转移的电子数为1.2NA
难度: 中等查看答案及解析
-
“天宫一号”使用镍氢电池供电。镍氢电池的负极材料为储氢合金(用—表示,氢以单原子填入合金晶格),总反应为
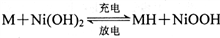 ,下列说法正确的是
,下列说法正确的是A. 电池充电时氢原子被氧化
B. 电池放电时正极为NiOOH
C. 电池充电时,与电源负极相连的电极反应为:
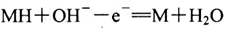
D. 电池放电时,负极反应为:
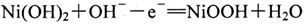
难度: 中等查看答案及解析
-
过碳酸钠(
 )在生产和生活领域应用广泛,其制备反应为:
)在生产和生活领域应用广泛,其制备反应为:
 。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是
。过碳酸钠具有Na2CO3和H2O2的双重性质, 在500C时分解为碳酸钠和过氧化氢。下列有关说法错误的是A. 实验室制备过碳酸钠时可釆用冷水浴控制反应温度
B. 过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂
C. 过碳酸钠应密封保存,放置于冷暗处
D. 过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体
难度: 中等查看答案及解析
-
一种白色固体可能由
 离子中的若干种组成, 陶宝同学设计实验检验其组成,记录如下:
离子中的若干种组成, 陶宝同学设计实验检验其组成,记录如下:
下列关于固体组成的结论错误的是
A. 肯定含有
和
B. 至少含有
 中的一种离子
中的一种离子C. 肯定不含Ba2+,一定含有Cl- D. 无需焰色反应即可断定溶液中含有Na+
难度: 困难查看答案及解析
-
人体吸入CO后在肺中发生反应
 导致人体缺氧。向某血样中通 入CO与O2的混合气
导致人体缺氧。向某血样中通 入CO与O2的混合气 ,氧合血红蛋白 HbO2浓度随时间变化曲线如下图所示。下列说法正确的是
,氧合血红蛋白 HbO2浓度随时间变化曲线如下图所示。下列说法正确的是
A. 反应开始至4s内用HbO2表示的平均反应速率为

B. 反应达平衡之前,O2与HbCO的反应速率逐渐减小
C. 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理
D. 该温度下反应
 的平衡常数为107
的平衡常数为107难度: 困难查看答案及解析
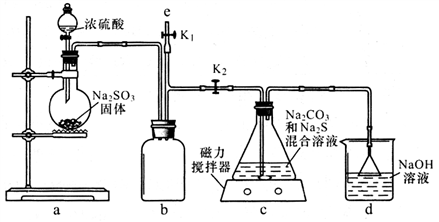
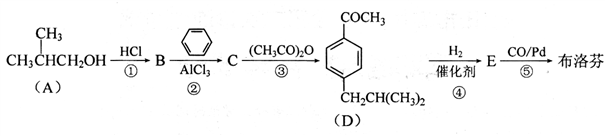
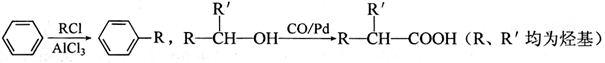
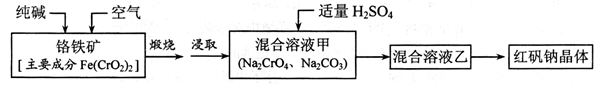
 配平上述化学反应方程式。
配平上述化学反应方程式。