-
下列说法不正确的是
A.胶体的分散质粒子直径大小介于溶液与浊液之间
B.金属冶炼通常利用氧化还原反应原理
C.陶瓷、水泥和光导纤维均属于硅酸盐材料
D.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霆天气
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是
A.乙醇和乙酸均可与钠反应放出氢气
B.乙烯和苯使溴水褪色的原理相同
C.丙烷(C3H8)和乙醇( C2H5OH)均存在同分异构体
D.糖类、油脂、蛋白质均为高分子化合物
难度: 中等查看答案及解析
-
短周期元素X,Y,Z,W在周期表中相对位置如下图所示,Y元素在地壳中的含量最高。下列说法正确的是
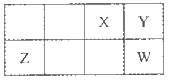
A.原子半径;Z<Y<W
B.最简单气态氢化物的热稳定性:Y<W
C.含X的化合物形成的溶液一定呈酸性
D.X的最简单阴离子和Z的最简单阳离子核外电子数相同
难度: 中等查看答案及解析
-
下图中仪器使用或操作正确的是

难度: 中等查看答案及解析
-
对100mL 1mol·L-1的Na2CO3溶液,下列说法不正确的是
A.将溶液稀释,
减少
B.滴人含0.l mol CH3COOH的溶液:c ( CH3 COO一)<c( HCO3一)
C.通人0.1 mo1CO2气体,溶液中存在:c ( Na+)=c( CO32一)十c( HCO3一)+c(H2CO3)
D.滴人酚酞,微热,溶液颜色加深
难度: 中等查看答案及解析
-
粒子甲与粒子乙在溶液中的转化关系如下图所示,粒子甲不可能是
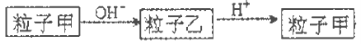
A.NH4+ B.Al C.HCO3一 D.SO2
难度: 中等查看答案及解析
-
在稀硫酸与锌反应制取氢气的实验中,探究加人硫酸铜溶液的量对氢气生成速率的影响。实验中Zn粒过量且颗粒大小相同,饱和硫酸铜溶液用量0一4.0mL,保持溶液总体积为100.0mL,记录获得相同体积(336 mL,)的气体所需时间,实验结果如图所示(气体体积均转化为标况下)。据图分析,下列说法不正确的是

A.饱和硫酸铜溶液用量过多不利于更快收集氢气
B.a ,c两点对应的氢气生成速率相等
C.b点对应的反应速率为v( H2SO4)=1.0x10-3mol·L -1 ·s-1
D.d点没有构成原电池,反应速率减慢
难度: 中等查看答案及解析