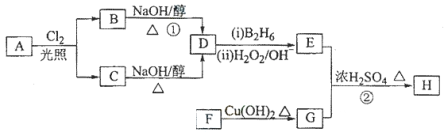
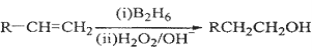-
下图为雾霾的主要成分示意图。下列说法不正确的是
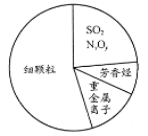
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
C.SO2和NxOy都属于酸性氧化物
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
难度: 中等查看答案及解析
-
下列关于①乙烯 ②苯 ③乙醇 ④乙酸 ⑤葡萄糖等有机物的叙述不正确的是
A.可以用新制的Cu(OH)2悬浊液鉴别③④⑤
B.只有①③⑤能使酸性KMnO4溶液褪色
C.只有②③④能发生取代反应
D.一定条件下,⑤可以转化为③
难度: 中等查看答案及解析
-
下列解释实验事实的方程式正确的是
A.Al2(SO4)3溶液滴加氨水产生白色胶状沉淀: Al3++3OH- = Al(OH)3↓
B.90 ℃时,测得纯水中c(H+)·c(OH-) =3.8×10—13: H2O(l)
H+(aq)+OH-(aq) H<0
C.FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2 +2H2O = 2Fe2++SO42 -+ 4H+
D.碳酸钠溶液滴入酚酞变红:CO32 -+ 2H2O
H2CO3+2OH-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA
B.256 g S8分子中含S-S键为7NA个
C.由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
难度: 中等查看答案及解析
-
分子式为C5H12O的醇与和它相对分子质量相同的一元羧酸进行酯化反应,生成的酯共有(不考虑立体异构)
A.15种 B.16种 C.17种 D.18种
难度: 中等查看答案及解析
-
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol/L,则该溶液中溶质的pC=3。下列叙述正确的是
A.某温度下任何电解质的水溶液中,pC(H+) +pC(OH-)=14
B.0.01 mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐减小
C.用0.01 mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大
D.某温度下,难溶性离子化合物AB的Ksp=1.0×10-10, 其饱和溶液中pC(A+)+pC(B-)=10
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
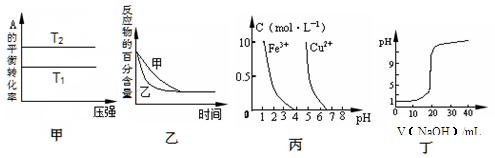
A.由图甲可以判断:对于反应aA(g)+ bB(g)
cC(g),若T1>T2, 则a +b=c且 H<0
B.图乙表示压强对可逆反应2A(g)+2 B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.根据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量NaOH溶液,调节pH≈4
D.图丁表示用0.1000 mol/L NaOH溶液滴定20.00 mL0.1000 mol/L醋酸溶液得到的滴定曲线
难度: 中等查看答案及解析