-
化学与生活、社会发展息息相关,下列有关说法正确的是( )
A. P2O5具有良好的吸水性,可用于干燥氨气
B. 用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似
C. “神州七号”的防护层中含聚四氟乙烯,制备聚四氟乙烯的单体属于不饱和烃
D. 由刘禹锡诗句“千淘万漉虽辛苦,吹尽狂沙始得金”可以看出金的化学性质稳定,可通过物理方法得到
难度: 简单查看答案及解析
-
用无机矿物资源生产部分材料,其产品流程示意图如下。下列有关说法不正确的是( )
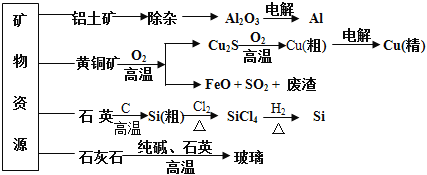
A. 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO
B. 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应
C. 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法
D. 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A. C4H8Cl2的同分异构体有10种
B. C2H6和C9H20一定互为同系物
C. 红葡萄酒储藏时间长后变香可能是因为乙醇发生了酯化反应
D. 石油裂解、煤的气化、蛋白质变性都包含化学变化
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA
B. 标准状况下,22.4L HF中含有的电子数为10NA
C. 1mol白磷(P4)分子中所含化学键的数目为4NA
D. 一定条件下,0.1mo1 Fe与0.2 molCl2充分反应,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. Fe3O4 溶于足量氢碘酸:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
B. 用石墨作电极电解AlC13溶液:2Cl–+2H2O
H2↑+ Cl2↑+2OH–
C. 澄清的石灰水中加入少量的 NaHCO3溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O
D. 向含1mol FeBr2的溶液中通入0.6mol Cl2:10Fe2+ + 4Br‾+ 8Cl2 = 10Fe3+ + 2Br2 + 16Cl‾
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是( )
A. 已知甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
B. 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 已知中和热为△H=-57.4kJ•mol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A. CS2的电子式:
B. 次氯酸结构式:H-Cl-O
C. 中子数为16的磷原子:
P D. 甲烷的球棍模型:
难度: 简单查看答案及解析
-
某无色溶液中可能含有①Na+②Ba2+③Cl-④Br-⑤SO32- ⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
(1)用pH试纸检验溶液的pH大于7;
(2)向溶液中滴加氯水,再加入CCl4振荡,静置CCl4层呈橙色;
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生;
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生。下列结论正确的是( )
A. 肯定含有的离子是①④⑤ B. 肯定没有的离子是②⑥
C. 不能确定的离子是① D. 不能确定的离子是③⑤
难度: 中等查看答案及解析
-
右图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
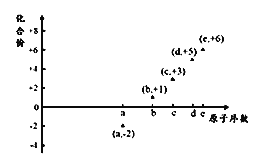
A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. 工业上常用电解法制备单质b和c
D. a和b形成的化合物不可能含共价键
难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3。下列说法正确的是( )
A. 制取NF3的反应中,氧化剂与还原剂的物质的量之比为3∶1
B. 在NF3与H2O的反应中,H2O作还原剂
C. 若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol
D. NF3在空气中一旦泄漏,不易于发现
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 地沟油经过加工处理可用来制肥皂
B. NH3的水溶液可以导电,说明NH3是电解质
C. 糖类、油脂、蛋白质均为高分子化合物
D. 明矾溶于水生成氢氧化铝胶体,起消毒杀菌的作用
难度: 简单查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. c(I-)=0.lmol·L-1的溶液中:Na+、Mg2+、ClO-、SO42-
B. 使甲基橙变红色的溶液中:K+、NH4+、HCO3-、Cl-
C. 无色透明的溶液中:Al3+、Cu2+、SO42-、Cl-
D. 由水电离产生的c(OH-)=l×10-10mol·L-1的溶液中:Ba2+、K+、NO3-、Cl-
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是( )
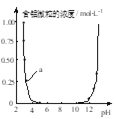
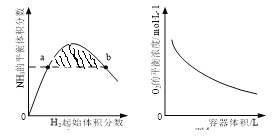
甲 乙 丙 丁
A. 图甲中阴影部分的面积表示v(正)与v (逆)的差值
B. 图乙表示溶液中含铝微粒浓度随pH变化曲线,a点所示溶液中存在大量AlO
C. 图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图丁表示同一温度下,在不同容积的容器中进行反应2BaO2(s)
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
难度: 中等查看答案及解析
-
25℃时,下列说法正确的是( )
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有
③物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) =2c(H+) + c(CH3COOH)
④在0.1 mol/l氨水中滴加0.1 mol/l盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A. ①④ B. ②③ C. ③④ D. ①②
难度: 困难查看答案及解析
-
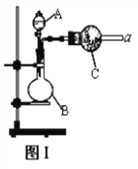
侯德榜制碱法的反应原理为NH3+CO2+H2O+NaCl = NaHCO3↓+NH4Cl,下列装置制取碳酸钠粗品能达到实验目的的是( )
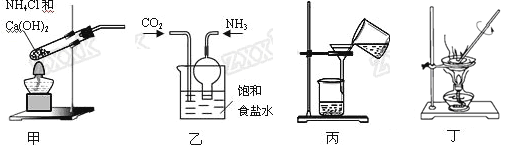
A. 用装置甲制取氨气 B. 用装置乙制取碳酸氢钠
C. 用装置丙分离碳酸氢钠 D. 用装置丁加热碳酸氢钠制备碳酸钠
难度: 中等查看答案及解析
-
—定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g)
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是( )
容器
温度/K
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
CO2(g)
H2(g)
C2H5OH(g)
H2O(g)
C2H5OH(g)
甲
500
0.20
0.60
0
0
0.083
乙
500
0.40
1.20
0
0
丙
600
0
0
0.10
0.30
0.039
A. 该反应正反应为吸热反应
B. 达平衡时,甲、乙容器内:2c(CO2,甲)<c(CO2,乙)
C. 达平衡时,容器甲中的逆反应速率比容器乙中的大
D. 达平衡时,转化率:a(CO2,甲)+a(C2H5OH,丙)>1
难度: 困难查看答案及解析
-
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi
LixV2O5。下列说法合理的是( )
A. 电池在放电时,Li+向负极移动
B. 锂在放电时作正极,充电时作阳极
C. 该电池充电时阳极的反应为LixV2O5 - xe- =V2O5 + xLi+
D. V2O5只是锂发生反应的载体,不参与电池反应
难度: 困难查看答案及解析
-
已知常温下:Ksp〔Mg(OH)2〕=1.2×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,Ksp(CH3COOAg)=2.3×10-3,下列叙述正确的是( )
A. 等体积混合浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液一定不产生CH3COOAg沉淀
B. 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀
C. 在Mg2+为0.12 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH至少要控制在9以上
D. 向1ml 0.1 mol•L-1AgNO3溶液中加入2滴0.1 mol•L-1NaCl溶液产生白色沉淀,再滴加2滴0.1 mol•L-1KI溶液,又产生黄色沉淀,证明相同温度下Ksp(AgCl)大于Ksp(AgI)
难度: 中等查看答案及解析
-
下列是25 ℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式
CH3COOH
HClO
H2CO3
Ka
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11
A. 相同浓度CH3COONa和NaClO的混合溶液中,各种离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5:9,此时溶液的pH=5
C. 次氯酸钠溶液中通入少量CO2的离子方程式为:2ClO-+CO2+H2O=CO32 -+2HClO
D. pH相同的CH3COONa溶液、NaClO溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3) >c(NaClO ) >c(NaOH )
难度: 困难查看答案及解析
-
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )
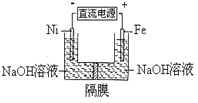
A. 铁是阳极,电极反应为Fe-6e-+4H2O=FeO42-+ 8H+
B. 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是 ( )
A. 在0.1 mol/lNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B. 在0.1 mol/lNa2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3)
C. NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D. 等pH的①(NH4)2SO4 ②NH4HSO4 ③NH4Cl,NH4+浓度由大到小的顺序是③>①>②
难度: 困难查看答案及解析
-
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是( )
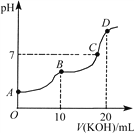
A. KHC2O4溶液呈弱碱性
B. B点时:c(K+)>c(HC2O4-)> c(C2O42-)>c(H+)>c(OH-)
C. C点时:c(K+)>c(HC2O4-)+c(C2O42-)+c(H2C2O4)
D. D点时:c(C2O42-)+c(HC2O4-)+c(H2C2O4)=0.1 mol·L-1
难度: 中等查看答案及解析