-
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤;正确的操作顺序是( )
A.③②①⑤④
B.①②③⑤④
C.②③①④⑤
D.③⑤②①④难度: 中等查看答案及解析
-
在无色强酸性溶液中,下列各组离子能够大量共存的是( )
A.Cl-、Na+、NO3-、Ca2+
B.NH4+、HCO3-、Cl-、K+
C.K+、Ba2+、Cl-、SO42-
D.Cu2+、NH4+、I-、Cl-难度: 中等查看答案及解析
-
我国合成了多种元素的新同位素,其中一种是72185Hf(铪),它的中子数是( )
A.72
B.113
C.185
D.257难度: 中等查看答案及解析
-
“NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl”是著名的“侯氏制碱法”的重要反应.下面是4位同学对该反应涉及的有关知识发表的部分见解.其中不正确的( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
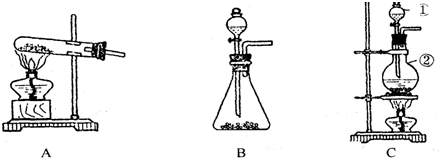
下列仪器常用于物质分离的是( )

A.①③⑤
B.②③⑤
C.②④⑤
D.①②⑥难度: 中等查看答案及解析
-
现有NaCl、MgCl2、AlCl3、CuCl2、FeCl3、NH4Cl六种溶液,如果只用一种试剂鉴别它们,应选用的试剂是( )
A.浓NaOH
B.AgNO3
C.浓氨水
D.H2SO4难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.氨气通入稀盐酸溶液中:NH3+H+=NH4+
B.碳酸钡与醋酸反应:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
C.SO2通入氯水中:SO2+Cl2+2H2O=2H++2Cl-+H2SO4
D.FeCl3溶液中加入过量氨水:Fe3++3OH-=Fe(OH)3↓难度: 中等查看答案及解析
-
用1L 1mol•L-1NaOH溶液吸收0.9molCO2,所得溶液中的CO32-和HCO3-的物质的量浓度之比是( )
A.5:4
B.4:5
C.1:8
D.8:1难度: 中等查看答案及解析
-
用98%、密度为1.84g/cm3的浓H2SO4配制1 mol•L-1的稀硫酸100mL,现给出下列可能用到仪器:①100mL量筒;②10mL量筒;③50mL烧杯;④托盘天平;⑤100mL容量瓶;⑥胶头滴管;⑦玻璃棒.按使用仪器先后顺序排列正确的是( )
A.②③⑦⑤⑥
B.②⑤⑦⑥
C.①③⑤⑦④⑥
D.④③⑦⑤⑥难度: 中等查看答案及解析
-
以下物质间的每步转化通过一步反应能实现的是( )
A.Al-Al2O3-Al(OH)3-NaAlO2
B.Fe-FeCl2-Fe(OH)2-Fe(OH)3
C.S-SO3-H2SO4-MgSO4
D.N2-NO2-HNO3-NO难度: 中等查看答案及解析
-
一般情况下,得到电子的能力越强,物质的氧化性就越强;失去电子的能力越强,物质的还原性就越强.现有三个氧化还原反应:
①2FeCl3+2KI═2FeCl2+2KCl+I2
②2FeCl2+Cl2═2FeCl3
③2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,
若某溶液中有Fe2+、I-、Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是( )
A.Cl2
B.KMnO4
C.FeCl3
D.HCl难度: 中等查看答案及解析
-
将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的量与加入X的物质的量关系如下图所示,符合图示情况的是( )
A B C D X CO2 HCl NaOH AlCl3 Y Ca(OH)2 NaAlO2 AlCl3 NaOH 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
有一充有10mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有6mL无色气体,则原混合气体中NO和NO2体积比为( )
A.1:4
B.2:3
C.3:2
D.4:1难度: 中等查看答案及解析
-
Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NaClO与NaClO3的物质的量之比为1:2,则反应中被氧化的Cl2与被还原的Cl2的物质的量之比为( )
A.2:3
B.4:3
C.10:3
D.3:11难度: 中等查看答案及解析
-
下列物质中既能跟稀硫酸,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②(NH4)2CO3③Al2O3④Al(OH)3⑤Al.
A.只有①③
B.全部
C.只有①②④⑤
D.只有①③④⑤难度: 中等查看答案及解析
-
某混合溶液中含MgCl2的浓度为2mol/L,含AlCl3的浓度为3mol/L,则将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,至少需要1.6mol/L氢氧化钠溶液的体积是( )
A.3.2L
B.1.5L
C.2.0L
D.1.8L难度: 中等查看答案及解析