-
化学与人类生活密切相关,下列与化学有关的说法不正确的是( )
A.化石燃料燃烧和工业废气中的氢氧化物均是导致“雾霾天气”的元凶
B.开发和推广新能源是实现低碳生活的途径之一
C.粮食酿酒主要经过了淀粉→葡萄糖→乙醇的化学变化过程
D.化学药品着火,都要立即用水或泡沫灭火器灭火
难度: 简单查看答案及解析
-
分子式为C9H12O属于芳香醇且苯环上有三个取代基的同分异构体共有( )
A.4种 B.5种 C.6种 D.8种
难度: 困难查看答案及解析
-
下列解释事实的化学方程式或离子方程式不正确的是( )
A.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
B.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
C.在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2
D.在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
难度: 困难查看答案及解析
-
NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.在熔融状态下,1molNa2O2完全电离出的离子数目为3NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数m NA /14
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为 NA
难度: 中等查看答案及解析
-
下列实验装置能达到相关实验目的的是( )
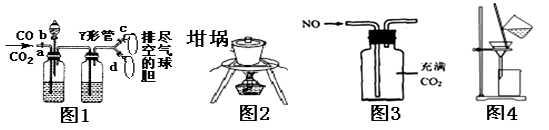
A.图1可用于分离收集CO和CO2
B.图2可用于从食盐水中提取NaCl晶体
C.图3用于收集NO
D.图4用于氢氧化铁胶体和硫酸钠溶液的分离
难度: 中等查看答案及解析
-
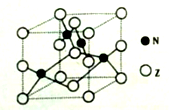
在一个恒容绝热的密闭容器中,发生可逆反应:M(?)+2N(g)
P(g)+Q(g) △H>0,已知M的状态未知,则下列描述一定达到平衡的标志是( )
①当物质M、N、P的体积分数比为 1:1:1时
②混合气体的密度不变时
③体系的温度不变时
④反应速率2v (N)正=v (Q)逆时
⑤体系的压强不变时
⑥气体的平均相对分子质量不变时
A.①③④ B.③⑤⑥ C.②③⑥ D.③④⑤
难度: 困难查看答案及解析
-
常温下,相同pH的氢氧化钠溶液和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是( )
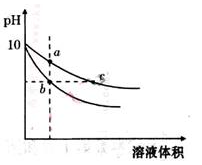
A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中:C(H+)+C(CH3COOH)=C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc
难度: 困难查看答案及解析





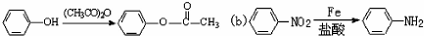
 的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
的合成路线_______________________________________(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)