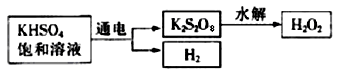
-
化学与生活密切相关。下列说法不正确的是
A.用含增塑剂的聚氯乙烯薄膜作食品包装材料
B.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
C.次氯酸钠溶液可用于环境的消毒杀菌
D.中国古代用明矾溶液的酸性清洗铜镜表面的铜锈
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A.电解精炼铜,当电路中通过的电子数为0.1NA时,阳极质量减少为3.2g
B.0.5L1 mol•L-1NaHS溶液中,Na+和HS-离子数之和为NA
C.Na2O2和Na2S的固体混合物7.8g,其中Na+数为0.3NA
D.3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA
难度: 困难查看答案及解析
-
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项
①中物质
②中物质
预测②中的现象
A
稀H2SO4
纯碱溶液
立即产生气泡
B
无水乙醇
酸性K2Cr2O7
溶液立即褪色
C
偏铝酸钠溶液
稀盐酸
立即产生白色沉淀
D
稀盐酸
滴有酚酞的水玻璃
产生胶冻状的凝胶
难度: 中等查看答案及解析
-
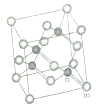
金刚烷的结构如图所示,其二氯代物有(不考虑立体异构)

A.5种 B.6种 C.7种 D.8种
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.以石墨作电极电解氯化铝溶液:2Cl-+2H2O
2OH-+H2↑+Cl2↑
D.FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
难度: 困难查看答案及解析
-
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是
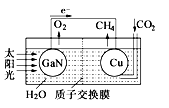
A.该过程是将太阳能转化为化学能的过程
B.GaN表面发生氧化反应,有O2产生
C.电解液中的H+从质子交换膜右侧向左侧迁移
D.Cu表面的电极反应式 CO2+8e-+8H+=CH4+2H2O
难度: 困难查看答案及解析
-
室温下,下列溶液中粒子浓度关系不正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1 mol•L-1NaHCO3溶液与0.1NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
C.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:2 c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)]
难度: 困难查看答案及解析

 。
。