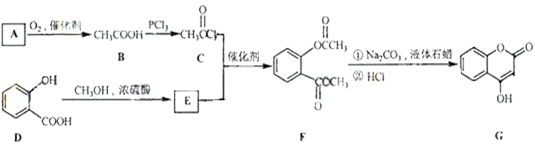
-
下列说法正确的是
A.在标准状况下,22.4L SO3所含有的氧原子数为3×6.02×1023
B.在标准状况下,22.4LNO和NO2的混合气中,所含有氮原子的个数为6.02×1023
C.20mL0.1mol·L—1NaCl与10mL0.1mol·L—1BaCl2溶液中氯离子物质的量浓度相等
D.在Na2O2与水的反应中,生成1mol O2转移的电子数为4×6.02×1023
难度: 中等查看答案及解析
-
下列各组液体混合物中,能用分液漏斗分离的是
A.淀粉溶液和食盐溶液 B.CCl4和水
C.乙酸和乙酸乙酯 D.乙酸和乙醇
难度: 中等查看答案及解析
-
下列化合物的分子中,所有原子都处于同一平面的是
A. 乙酸 B. 甲苯 C. 甲醇 D. 四氟乙烯
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:
元素代号
a
b
c
d
e
原子半径/nm
0.089
0.074
0.160
0.143
0.102
主要化合价
+2
-2
+2
+3
+6 -2
下列说法正确的是
A.b和e所形成的化合物一定能使酸性高锰酸钾溶液褪色
B.a的单质与稀硫酸反应的速率比c快
C.d的氢氧化物为两性氢氧化物
D.这些元素应位于周期表中的同一周期
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离产生的氢离子和氢氧根离子浓度的乘积为1×10—20。则一定能在该溶液中大量共存的离子组是
A.Ca2+、Na+、Cl— 、NO3— B.NO3—、Fe3+、Mg2+、SO42—
C.ClO—、CH3COO—、Na+ 、Br— D.K+、Cl—、Al3+、SO32—
难度: 中等查看答案及解析
-
下列离子反应方程式正确的是
A.H2O2+2OH—
2H2O +O2↑
B.Cl2+6OH—
ClO3—+5Cl—+3H2O
C.2MnO4—+H2O2+6H+=2Mn2++3O2↑+4H2O
D.3MnO42—+4H+=2MnO4—+MnO2+2H2O
难度: 中等查看答案及解析
-
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。下列说法中不正确的是
A.该电池的负极反应为2SOCl2 + 4e— = S +SO2+4Cl—
B.该电池的负极反应为4Li = 4Li+ + 4e—
C.反应SOCl2 + H2O = SO2↑ + 2HCl↑为非氧化还原反应
D.组装该电池必须在无水的条件下进行
难度: 中等查看答案及解析