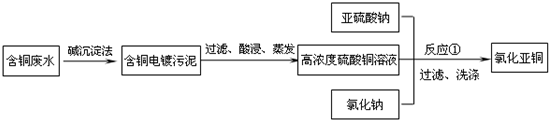
-
下列实验操作完全正确的是( )
编号 实 验 操 作 A 钠与水的反应 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 B 配制一定浓度的氯化钾溶液1000mL 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 C 排除碱式滴定管尖嘴部分的气泡 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 D 取出分液漏斗中所需的上层液体 下层液体从分液漏斗下端管口流出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
我国是世界上严重缺碘的地区,全国有约四亿多人缺碘,因此我国政府规定:国内销售的食盐必须加碘.关于加碘盐的下列叙述中不正确的是( )
A.加碘食盐开袋后,不宜长期放置后再食用
B.加碘食盐中加入的是单质碘
C.加碘食盐中加入的是碘酸钾
D.加碘食盐在使用过程中,不宜长时间高温加热难度: 中等查看答案及解析
-
下列物质保存方法正确的是( )
A.锂保存在煤油中
B.NaOH固体保存在细口试剂瓶中
C.浓硫酸保存在细口试剂瓶中(玻璃塞)
D.氢氟酸用玻璃试剂瓶保存难度: 中等查看答案及解析
-
在国庆60周年阅兵式上,展示了我国研制的各种导弹.导弹之所以有神奇的命中率,是制导弹合金材料中的稀土元素钕(60Nd)的贡献.下列说法正确的是( )
A.60142Nd、60143Nd和60144Nd互为同素异形体
B.60142Nd、60143Nd和60144Nd的化学性质不同
C.60142Nd原子中含有60个质子和142个中子
D.60142Nd、60143Nd和60144Nd都是钕元素的不同核素难度: 中等查看答案及解析
-
下列变化必须加入氧化剂才能完成的是( )
A.KMnO4→MnO2
B.Fe2+→Fe3+
C.I2→I-
D.Cl2→ClO-难度: 中等查看答案及解析
-
下列各组液体混合物,能用分液漏斗分离的是( )
A.乙酸和水
B.溴苯和苯
C.己烷和水
D.乙醇和水难度: 中等查看答案及解析
-
下列各组离子中,能在溶液中大量共存的是( )
A.H+、Na+、HCO3-、Cl-
B.Ba2+、Na+、OH-、Cl-
C.Ag+、K+、NO3-、CO32-
D.Cu2+、Ag+、Cl-、OH-难度: 中等查看答案及解析
-
随着卤素原子半径的增大,下列递变规律正确的是( )
A.单质的熔点逐渐降低
B.卤素离子还原性逐渐增强
C.气态氢化物稳定性逐渐增强
D.单质氧化性逐渐增强难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.氢氧化钡晶体与氯化铵晶体的反应是放热反应
B.煤、石油、天然气等是化石燃料
C.直接燃烧煤比将煤进行处理转化为气体或液体燃料再燃烧效果好
D.反应物的总能量高于生成物的总能量时,发生吸热反应难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4═Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
实验 反应温度/℃ Na2S2O3溶液 稀H2SO4 H2O V/mL c/ V/mL c/ V/mL A 25 5 0.1 10 0.1 5 B 25 5 0.2 5 0.2 10 C 35 5 0.1 10 0.1 5 D 35 5 0.2 5 0.2 10
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
根据下列各反应现象所归纳的元素性质不正确的是( )
A.将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出.不能说明钠的金属性比铜弱
B.用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝.说明氯元素的非金属性比碘元素强
C.把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出.说明Cl的非金属性比S强
D.将0.1molNa、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1mol、0.2mol、0.3mol.说明这三种金属的活泼性为:Al>Mg>Na难度: 中等查看答案及解析
-
在一定条件下,下列物质①CO2,②Cl2,③浓硝酸,④NH3,⑤FeCl3,其中能跟某些金属、非金属、酸、碱都能发生反应的是( )
A.①④
B.②③
C.①④⑤
D.②③⑤难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列有关说法正确的是( )
A.7.8gNa2O2含有的阴离子数目为0.2NA
B.2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2NA
C.常温常压下,NA个氢分子与NA个氦分子含有的质子数相同
D.标准状况下,2.24LSO3含有分子数为0.1NA难度: 中等查看答案及解析
-
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为( )
A.NO2
B.N2O2
C.N2O
D.N2O4难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A.向次氯酸钙溶液中通入过量CO2气体:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO
B.向次氯酸钙溶液中通入SO2气体:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO
C.氢氧化钙溶液与碳酸氢镁溶液反应:Ca2++OH-+═CaCO3↓+H2O
D.在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++═3Fe3++2H2O+NO↑
难度: 中等查看答案及解析
-
在标准状况下,m g气体A与n g气体B的体积相同,则下列说法正确的是( )
A.相同状况下,ρA:ρB=m:n
B.MA:MB=n:m
C.相同质量时,NA:NB=m:n
D.等V、等m时,PA:PB=m:n难度: 中等查看答案及解析
-
锂离子电池因其工作电压高(3.6V)、无污染等优点倍受市场青睐.最常见的一种锂离子电池工作原理是:C6+LiCoO2
Li1-xCoO2+LixC6下列有关这种锂离子电池的说法错误的是( )
A.电池内部运载电荷的是Li+
B.负极材料是填充了金属锂的石墨(LixC6)
C.锂离子电池电解质溶液是Li+盐的水溶液
D.放电时的正极反应为Li1-xCoO2+xLi++xe-=LiCoO2难度: 中等查看答案及解析
-
短周期元家W、X、Y、Z 的原子序数依次增大,W与Y、X与Z 位于同一主族.W 与X 可形成共价化合物WX2.Y原子的内层电子总数是其最外层电子数的2.5 倍•下列叙述中不正确的是( )
A.WX2分子中所有原子最外层都为8电子结构
B.WX2、ZX2的化学键类型和晶体类型都相同
C.WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为X<W<Y<Z难度: 中等查看答案及解析
-
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果.下列表达不正确的是( )
A.密闭容器中CuO和C高温反应的气体产物: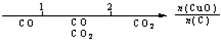
B.Fe在Cl2中的燃烧产物:
C.AlCl3溶液中滴加NaOH后铝元素的存在形式:
D.氨水与SO2反应后溶液中的铵盐: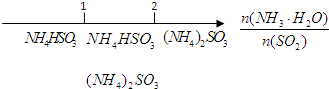
难度: 中等查看答案及解析
-
将一定量Fe、FeO和Fe2O3的混合物放入2mol/L的HNO3溶液25mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
A.40mL
B.45mL
C.50mL
D.无法确定难度: 中等查看答案及解析