-
化学与生产、生活密切相关,下列说法不正确的是
A.石油的分馏、石油的裂解过程中都发生了化学变化
B.玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料
C.用纯碱溶液清洗油污时,加热可以提高去污能力
D.高纯硅广泛应用于太阳能电池、计算机芯片
难度: 简单查看答案及解析
-
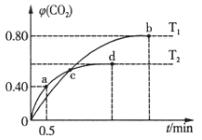
设NA为阿伏加德罗常数的数值,T列说法正确的是
A.一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA
B.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
C.11 g超重水(T2O)含中子数为5NA
D.常温常压下,11.2 L Cl2含氯原子数为NA
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示,有关该物质的描述不正确的是

A.该物质的分子式为C11H12O3
B.该物质属于芳香族化合物
C.该物质能使溴水和酸性高锰酸钾溶液褪色,反应类型也相同
D.该物质在一定条件下反应能得到环状的酯
难度: 简单查看答案及解析
-
肼(N2H4)又称联氨,可用如下方法制备:CO(NH2)2 + ClO- + OH- — N2H4 + Cl- + CO32- + H2O [CO(NH2)2中N为-3价,方程式未配平],下列说法不正确的是
A.N2H4是氧化产物
B.N2H4中存在极性键和非极性键
C.配平后,OH-的化学计量数为2
D.生成3.2 g N2H4转移0.1 mol电子
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A.含等物质的量的MgCl2、Ba(OH)2、HNO3三种溶液混合:Mg2+ + 2OH- = Mg(OH)2↓
B.CaCO3溶于CH3COOH:CaCO3 + 2CH3COOH = Ca2+ + 2CH3COO- + CO2↑ + H2O
C.过量HI溶液加入到Fe(NO3)3溶液中:2Fe3+ + 2I- = 2Fe2+ + I2
D.SO2通入到溴水中:SO2 + H2O + Br2 = 2H+ + SO42- + 2Br-
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
选项
实验目的
实验操作
A
检验蔗糖水解产物中的葡萄糖
取1 mL 20%蔗糖溶液,加入少量稀硫酸,水浴加热后取少量溶液,加入几滴新制Cu(OH)2,加热
B
除去乙烷中混有的少量乙烯
将混合气体通入足量酸性KMnO4溶液中
C
验证Mg(OH)2沉淀可以转化为Fe(OH)3沉淀
向2 mL 1 mol/L NaOH溶液中加入几滴1 mol/L MgCl2溶液,生成白色沉淀,再加入几滴1 mol/L FeCl3溶液
D
硅酸胶体的制备
向Na2SiO3溶液(饱和溶液1 : 2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失
难度: 中等查看答案及解析
-
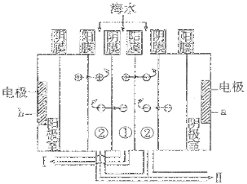
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是

A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
难度: 困难查看答案及解析




 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: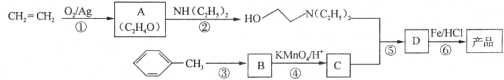
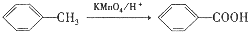
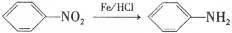
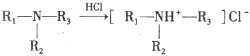
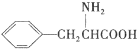 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式____________________________________________________________。