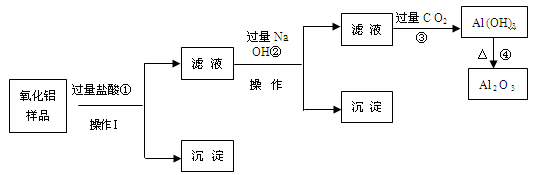
-
久置在空气中不易变质的物质是
A.纯碱 B.漂白粉 C.水玻璃 D.氯水
难度: 中等查看答案及解析
-
下列物质中属于强电解质的是
A.NH3 B.乙醇 C.Cu D.NaCl
难度: 简单查看答案及解析
-
通过溶解、过滤、蒸发等操作,可将下列各组混合物分离的是
A.硝酸钠 氢氧化钠 B.氧化铜 二氧化锰
C.氯化钾 碳酸钙 D.硫酸铜 氢氧化钠
难度: 中等查看答案及解析
-
下列能达到实验目的的是
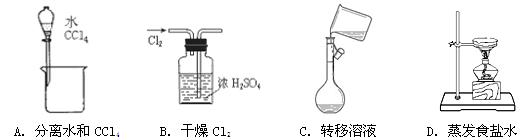
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g Fe和足量的盐酸完全反应失去电子数为0.3 NA
B.22.4L SO2含有NA个SO2分子
C.1.6g CH4所含的电子数为NA
D.标况下,4.48L的水中含有H2O分子的数目为0.2NA
难度: 中等查看答案及解析
-
用铝箔包裹着2.3克金属钠投入到足量水中,理论上可以收集到氢气物质的量为
A.0.05mol B.0.2mol
C.大于0.05mol小于等于0.2mol D.无法判断
难度: 中等查看答案及解析
-
下列各组气体中,通常状况下能够共存,并且都能用浓硫酸干燥的是
A.HCl、N2、NH3 B.Cl2、CO2、O2
C.NO、O2、N2 D.CO2、CO、NH3
难度: 简单查看答案及解析
-
下列图示的四种实验操作名称从左到右依次是
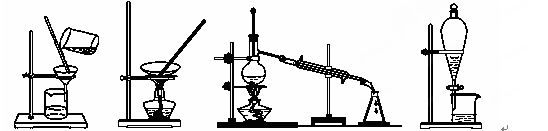
A.蒸发、蒸馏、过滤、萃取 B.过滤、蒸馏、蒸发、萃取
C.过滤、蒸发、蒸馏、分液 D.萃取、蒸馏、蒸发、过滤
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+ 3H+=Fe3++ 3H2O
B.用醋酸除去水垢:CaCO3+2H+=Ca2++ H2O+CO2↑
C.氯气与水的反应:Cl2+H2O=2H++Cl—+ClO—
D.等体积、等浓度的Ca(HCO3)2溶液和NaOH溶液混合:Ca2++HCO3—+OH—=CaCO3↓+H2O
难度: 中等查看答案及解析
-
将O2、CH4、Na2O2 放入密闭容器中,在150℃条件下用电火花引燃,充分反应后,容器中无气体,且将残余物溶于水中无气体放出。则O2、CH4、Na2O2的物质的量之比与反应后容器内固体的成分为
A.1:2:6 ;Na2CO3和NaHCO3 B.2:1:4 ;Na2CO3
C.1:2:6; Na2CO3和NaOH D.2:1:4; Na2CO3和NaOH
难度: 困难查看答案及解析
-
离子方程式H+ + OH-= H2O可表示的化学方程式是
A.盐酸与氢氧化铜的反应 B.硫酸氢钠与氢氧化钠的反应
C.硫酸与氢氧化镁的反应 D.盐酸与氨水的反应
难度: 简单查看答案及解析
-
把7.4 g Na2CO3·10H2O和NaHCO3组成的固体混合物溶于水配成100 mL溶液,其中c(Na+)=0.6 mol·L-1。若把等质量的固体混合物加热至恒重,残留固体的质量是
A.3.18 g B.2.12 g C.4.22 g D.5.28 g
难度: 中等查看答案及解析
-
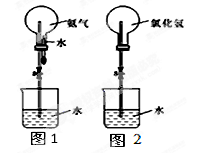
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是
选项
A
B
C
D
实验项目
除去KCl中少
的 MnO2
用10mol/L的盐酸配制100mL0.1mol/L的盐酸
用氯化钠溶液制备氯化钠晶体
除去CO2气体中的HCl
实验仪器
或装置
烧杯、玻璃棒、分液漏斗
100mL容量瓶、玻璃棒、烧杯

图1
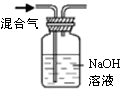
图2
难度: 中等查看答案及解析
-
下列说法正确的是
A.同温同压下,相同体积的物质,其物质的量一定相等
B.标准状况下气体摩尔体积约为22.4L
C.0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的数目之比为15∶2
D.150 mL 1 mol/L NaCl溶液与50 mL 1 mol/L AlCl3溶液中Cl-物质的量浓度相等
难度: 中等查看答案及解析
-
将SO2通入BaCI2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是
A.CO2 B.NH3 C.SO3 D.Cl2
难度: 中等查看答案及解析
-
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
难度: 简单查看答案及解析
-
证明某溶液只含有Fe2+而不含有Fe3+的实验方法是
A.先滴加氯水,再滴加KSCN溶液后显红色
B.先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C.滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
D.只需滴加KSCN溶液
难度: 简单查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
序号
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
Cl2
FeBr2
/
Fe3+ Br2
Cl-
②
KClO3
浓盐酸
/
Cl2
③
KMnO4
H2O2
H2SO4
O2
Mn2+
A.表中①组的反应可能有一种或两种元素被氧化
B.氧化性强弱的比较: KClO3>Fe3+>Cl2>Br2
C.表中②组反应的还原产物是KCl,电子转移数目是6e-
D.表中③组反应的离子方程式为:2MnO4-+ 3H2O2 + 6H+=2Mn2+ + 4O2↑+ 6H2O
难度: 中等查看答案及解析
-
向一定量的Cu、Fe2O3的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.3.2 g B.2.4 g C.1.6 g D.0.8 g
难度: 中等查看答案及解析
-
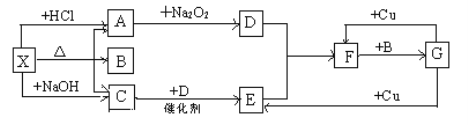
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
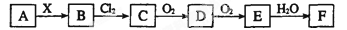
下列说法中不正确的是
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析