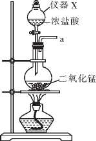
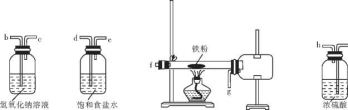
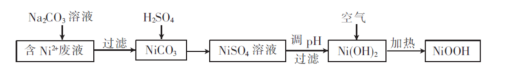
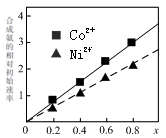
-
化学与社会、生产、生活紧密相关。下列说法正确的的是
A.化学危险品发生爆燃事故后,人员应该向上风方向撤离
B.含有硫酸的工业废水用硝酸钡处理后再排放有利于减少水体污染
C.用聚苯乙烯代替聚乙烯作食品包装袋,可节约成本,但是不利于人体健康和环保
D.“阅兵蓝”的出现说明京津冀实施道路限行和污染企业停工等措施,可以有效地减轻雾 霾和保证空气质量
难度: 简单查看答案及解析
-
中国计量科学研究院研制的NIM5铯原子喷泉钟,2000万年不差一秒,日前成为国际计量局认可的基准钟之一,参与国际标准时间修正。关于cs元素,下列说法正确的是
A.137Cs和133Cs互为同位素 B.单质Cs与水反应非常缓慢
C.137Cs比133Cs多4个中子 D. 137Cs最外层只有1个电子
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.C02分子的比例模型:
B.过氧化氢的电子式:H: O:O:H
C.氟原子的结构示意图:
D. H2CO3 的电离方程式:H2CO3
2H+ +CO32-
难度: 简单查看答案及解析
-
下列物质性质与应用关系不正确的是
A.MgO、Al2O3熔点高,可用于耐高温材料
B.Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂
C.S O2具有漂白性,能使滴有酚酞的Na0H溶液褪色
D.常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸
难度: 简单查看答案及解析
-
2015年10月5日,中国女药学家屠呦呦与另两位科学家共享2015年诺贝尔生理学或医学奖。屠呦呦因发现治疗疟疾新型药物青蒿素和双氢青蒿素而获奖。青蒿素的分子式为 C15H2205。下列有关说法中正确的是
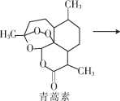
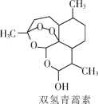
A.青蒿素中氧元素的质量为80 g
B.双氢青蒿素能发生酯化反应
C.双氢青蒿素能与溴水发生加成反应
D.青蒿素和双氢青蒿素均含有羟基
难度: 中等查看答案及解析
-
设Na为阿伏加德罗常数的数值。下列说法正确的是
A.常温常压下,7g NH3所含的电子数为0.8Na
B.标准状况下,11.2 L S03所含的氧原子数为 5Na
C.1mol Si02中含有Si—O键的数目为2Na
D.1mol Fe与足量的稀硝酸反应,转移的电子总数为3Na
难度: 中等查看答案及解析
-
近年来科学家制造出大量的新物质,对下列三种物质的相关说法的不正确的是

A.石墨烯具有良好的导电性
B.上述三种物质与金刚石互为同素异形体
C.石墨炔孔径略大于氢气分子的直径,可作压的提纯氢气薄膜
D.上述三种物质与浓硫酸都能发生反应,但反应产物不同
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. Na2O 溶于水:Na20+ H2O=2Na+ + 20H—
B.向 Ca(C10)2 溶液中通入过量 C02 : 2C10-+H20+C02=2HC1O+CO32-
C.用FeC13溶液腐蚀铜板:Fe3十十Cu=Fe2十十Cu2十
D.碳酸钙溶于稀醋酸:CaCO3+2H+=Ca2++CO2 +H20
难度: 简单查看答案及解析
-
下列化合物中同分异构体数目(不考虑立体异构)最少的是
A.分子式为C5 H12的烃经 B.分子式为C4H100的醇
C.分子式为C4 H8的烯烃 D.分子式为C3 H602的酯
难度: 中等查看答案及解析
-
下列物质的转化均能通过一步反应实现的是
A.NaAlO2 A1(OH)3 A1 B.N2 NO2 HNO3
C.NaOH Na2CO3 NaHCO3 D.FeS2 S03 H2SO4
难度: 简单查看答案及解析
-
下列根据实验操作和实验现象所得出的结论不正确的是

难度: 中等查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X 是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法的是不正确的是
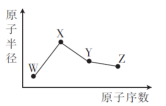
A.简单离子半径:W>X>Z
B.最简单气态氢化物的稳定性:Y<Z
C.化合物XZW中既含离子键又含共价键
D. Y的氧化物能与X的最高价氧化物对应的水化物反应
难度: 简单查看答案及解析
-
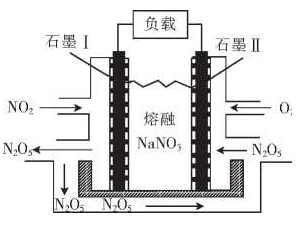
—种直接肼燃料电池的结构如图所示,下列说法正确的是
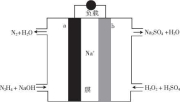
A.a极为电池的正极
B.电路中每转移6.02X1023个电子,则有1molNa+穿过膜向正极移动
C.b极的电极反应式为H202+2e-
20H-
D.用该电池电解饱和食盐水,当阳极生成2.24 L(标准状况)Cl2时,消耗肼0.1 mol
难度: 中等查看答案及解析
-
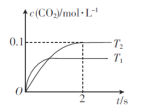
T °C时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)
XC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器
甲
乙
丙
反应物的投入量
3molA、2mol B
6molA、4molB
2molC
达到平衡的时间/ min
5
8
A的浓度/mol • L-1
C1
C2
C的体积分数/%
混合气体的密度/g • L-1
下列说法正确的是
A.若 x <4,,2C1 <C2
B.若 x = 4,则
=
C.无论x的值是多少贝均有
=
D.容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
难度: 困难查看答案及解析