-
下图表示了x、y、z事物间的从属关系,下列选项中不符合图中事物间从属关系的是

X
Y
Z
例
氧化物
化合物
纯净物
A
中和反应
复分解反应
化学反应
B
电解质
盐
化合物
C
胶体
分散系
混合物
D
碱性氧化物
金属氧化物
氧化物
难度: 简单查看答案及解析
-
对于化学反应A+B=C+D,下列说法中正确的是
A.若生成物C、D中有一种为单质,则该反应一定是置换反应
B.若生成物C和D分别为两种沉淀,A、B有可能为盐和碱
C.若C、D是盐和水,则A、B一定是酸和碱,
D.若C、D是两种化合物,则A、B一定是化合物
难度: 简单查看答案及解析
-
下列说法正确的是
A.氧化还原反应的本质是反应前后有元素化合价的升降
B.Ag+ + Cl- = AgCl↓ 的反应属于化合反应
C.从1 L 1 mol/L的H2SO4溶液中取出10 mL该溶液,其中H+浓度为2 mol/L
D.晶体硅是制造光导纤维的原料
难度: 简单查看答案及解析
-
下列实验操作中错误的是
A.用规格为10 mL 的量筒量取6 mL 的液体
B.用药匙或者纸槽把粉末状药品送入试管的底部
C.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D.如果没有试管夹,可以临时手持试管给固体或液体加热
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol N2所含有的原子数为NA
B.标准状况下,22.4 L水中含有的水分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.500 mL 1.0 mol/L碳酸钠溶液中所含钠离子的数为NA
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.碳酸钡与盐酸反应 2H+ + BaCO3 = Ba2+ + H2O + CO2↑
B.氢氧化钡溶液与稀硫酸混合 Ba2+ + SO42- + H++ OH-= BaSO4↓+ H2O
C.氯气通入蒸馏水中 Cl2 + H2O = Cl- + ClO- +2 H+
D.CO2通入过量的澄清石灰水中 CO2 + Ca(OH)2 = CaCO3↓+ H2O
难度: 简单查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
难度: 简单查看答案及解析
-
用98 %的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是
A.④③⑦⑤⑥ B.②⑤⑦⑥ C.①③⑤⑥⑦ D.②⑥③⑦⑤⑥
难度: 简单查看答案及解析
-
某混合气体可能含有CO、CO2、NH3、HCl、H2和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热的氧化铜(变红)和无水CuSO4(变蓝),则可断定该混合气一定有
A.HCl、CO2、H2 B.CO、H2、H2O C.CO、H2、NH3 D.HCl、CO、H2O
难度: 简单查看答案及解析
-
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是
A.SO2气体使高锰酸钾溶液褪色,表现了SO2的漂白性
B.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是Cu
C.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸
D. 常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸发应
难度: 简单查看答案及解析
-
被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,NaBH4+2H2O NaBO2+4H2↑,下列有关该反应的说法中,正确的是
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1:1
难度: 简单查看答案及解析
-
一定量的浓硝酸与过量的铜充分反应,生成的气体是
A.只有NO2 B.只有NO C.NO2和NO D.NO2和H2
难度: 简单查看答案及解析
-
图示的装置中,干燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛放同一种溶液。挤压胶头滴管,下列与实验事实不相符的是
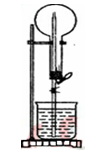
A.CO2(NaHCO3溶液)产生喷泉,得到无色溶液
B.NH3(H2O含酚酞) 产生喷泉,得到红色溶液
C.SO2(品红稀溶液) 产生喷泉,得到无色溶液
D.HCl(AgNO3溶液) 产生喷泉,得到白色悬浊液
难度: 简单查看答案及解析
-
已知浓H2SO4和Fe3+都可以将Cu氧化成Cu2+,浓H2SO4也可以将Br-氧化成Br2,Fe与Br2反应生成FeBr3。由此可以确定上述有关物质氧化性由强到弱的顺序为
A.浓H2SO4>Br2>Fe3+>Cu2+ B.浓H2SO4>Cu2+>Fe3+>Br2
C.Br2>浓H2SO4>Fe3+>Cu2+ D.Fe3+>Cu2+>Br2>浓H2SO4
难度: 简单查看答案及解析
-
一种盐X与氢氧化钠共热,可放出无色气体Y,Y经过一系列氧化后再溶于水可得Z溶液,Y和Z溶液反应又生成X,则X可能是下列中的
A.(NH4)2SO4 B.NH4NO3 C.NH4Cl D.NH4HCO3
难度: 简单查看答案及解析
-
50 mL的
溶液中所含有的
可以被20 mL 0.5
的
溶液全部沉淀,则
溶液中
的物质的量浓度为
A.1
B.0.8
C.0.2
D.0.1
难度: 简单查看答案及解析
-
把4.48 L CO2通过一定量的固体过氧化钠后收集到3.36 L气体(气体的测量均在标准状况下),则这3.36 L气体的质量是
A.4.8 g B.6.0 g C.5.6 g D.3.8 g
难度: 简单查看答案及解析