-
以下属于无机物的是
A. 四氯化碳 B. 石墨 C. 无水醋酸钠 D. 天然橡胶
难度: 简单查看答案及解析
-
某微粒结构示意图:
,有关该微粒的叙述正确的是
A. 中子数为10 B. 带12个单位正电荷
C. 电子式为Mg2+ D. 最外层电子数为0
难度: 简单查看答案及解析
-
下列化工生产没有涉及氧化还原反应的是
A. 工业合成氨 B. 工业制纯碱 C. 工业制烧碱 D. 工业制盐酸
难度: 简单查看答案及解析
-
下列与化学键相关的叙述中正确的是
A. 含共价键的化合物一定是共价化合物 B. 离子化合物中一定含有离子键
C. 离子键是阴阳离子的静电吸引 D. 极性键与非极性键无法共存
难度: 简单查看答案及解析
-
下列烃的衍生物可以发生加成反应的是
A. 乙醛 B. 乙酸 C. 乙醇 D. 乙酸乙酯
难度: 简单查看答案及解析
-
生活中的下列应用,没有发生化学变化的是
A. 氯气用作自来水的消毒剂 B. 用醋酸除去热水瓶中水垢
C. 二氧化硫用作纸浆漂白剂 D. 活性炭用作卫生间除臭剂
难度: 简单查看答案及解析
-
少量金属钠投入下列试剂中,反应最缓慢的是
A. 蒸馏水 B. 0.1mol/L盐酸
C. 0.1mol/L NaOH溶液 D. 无水乙醇
难度: 简单查看答案及解析
-
下列气体能用浓硫酸干燥的是
A. SO2 B. SO3 C. HI D. H2S
难度: 简单查看答案及解析
-
同一短周期元素X、Y、Z、W形成的最高价含氧酸的酸性依次增强,下列有关叙述正确的是
A. 单质沸点:X<Y<Z<W B. 气态氢化物的稳定性:X>Y>Z>W
C. 原子序数:X>Y>Z>W D. 最高正价:X<Y<Z<W
难度: 简单查看答案及解析
-
下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是
A. Na2O2和H2O B. Al和NaOH溶液
C. 食盐和浓硫酸共热 D. 铜片和浓硫酸共热
难度: 简单查看答案及解析
-
某学生配制0.2mol/L NaOH溶液时浓度偏小了,可能的原因是
A. 容量瓶中有残留水 B. 称好的NaOH发生潮解
C. 漏掉洗涤操作步骤 D. 摇匀后液面低于刻度线
难度: 简单查看答案及解析
-
下列装置或原理能达到实验目的的是
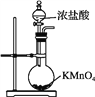
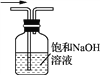
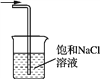
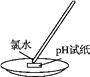
A. 制取Cl2 B. 除去Cl2中的HCl C. 氯气的尾气处理 D. 测氯水的pH
难度: 简单查看答案及解析
-
有7瓶氯盐溶液,阳离子分别是Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH4+、Na+等离子的溶液,只用一种试剂即可鉴别,该试剂可能是
A. KMnO4溶液 B. KSCN溶液 C. NaOH溶液 D. NH3 · H2O溶液
难度: 中等查看答案及解析
-
反应A(g) + 3B(g) ⇌2C(g) + 2D(g) 在四种不同情况下的反应速率分别为:①
、 ②
、 ③
、④
,该反应进行的快慢顺序为
A. ①>③=②>④ B. ①>②=③>④ C. ②>①=④>③ D. ①>④>②=③
难度: 简单查看答案及解析
-
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是
A. OH-+HCO3-→CO32-+H2O B. Cl2 + H2O ⇌ H++Cl-+ HClO
C. CO32-+2H+→CO2↑+H2O D. Ag++ Cl-→ AgCl↓
难度: 中等查看答案及解析
-
向如图所示装置中缓慢通入气体X,若打开活塞K,则品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊。X和Y可能是

选项
A
B
C
D
X
SO2
Cl2
HCl
Cl2
Y
NaOH溶液
饱和NaHCO3溶液
饱和NaCl溶液
Na2SO3溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图是2SO3(g) ⇌ 2SO2(g) + O2(g) 的能量变化图,据图得出的相关叙述正确的是
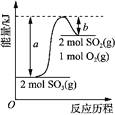
A. 2SO3(g) ⇌ 2SO2(g) + O2(g) + (a-b) kJ
B. 1mol SO2的能量比1mol SO3的能量高
C. 若有2mol SO3充分反应,吸收(a-b) kJ热量
D. 该化学反应过程中的能量变化既有吸热又有放热
难度: 中等查看答案及解析
-
物质的量浓度均为0.1mol/L的盐酸和醋酸溶液,下列说法正确的是
A. 两溶液加入等质量的锌粉,产生氢气的速率相同
B. 两溶液中氢氧根离子浓度均为
mol/L
C. 加入醋酸钠固体,二者的pH均增大
D. 与氢氧化钠反应至中性时,二者消耗氢氧化钠的质量相同
难度: 中等查看答案及解析
-
如图装置中X和Y均为石墨电极,电解液为滴有酚酞的某浓度NaCl溶液,电解一段时间后,X极附近溶液先变红。下列有关说法中正确的是

A. X极连接电源正极
B. X极上产生气体有刺激性气味
C. Y极上发生氧化反应
D. 电子从X极经过溶液流向Y极
难度: 中等查看答案及解析
-
某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2→4LiCl+S+SO2,下列有关判断正确的是(提示:SOCl2中S显
价)
A. 还原剂只有Li
B. SOCl2既是氧化剂又是还原剂
C. 还原产物包括LiCl和S
D. 生成1.12LSO2时,反应转移电子为0.2mol
难度: 中等查看答案及解析


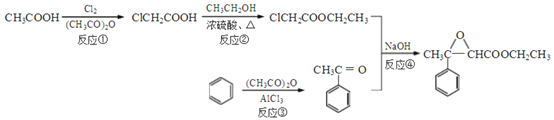
 。
。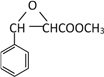 的合成路线(其它试剂任选)_______。
的合成路线(其它试剂任选)_______。