-
下列说法不正确的是( )
A. 生铁、不锈钢和黄铜都属于合金
B. 淀粉、油脂和蛋白质都属于天然高分子化合物
C. 水泥、玻璃和陶瓷都属于无机非金属材料
D. 天然气、液化石油气和汽油的主要成分都属于烃类
难度: 中等查看答案及解析
-
设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
A. 9.2g NO2和N2O4的混合物中含氮原子数目为0.2NA
B. 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA
C. 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA
D. 已知反应N2(g)+3H2(g)
2NH3(g)△H=-92.4kJ• mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ
难度: 中等查看答案及解析
-
下列关于苯和甲苯的说法正确的是( )
A. 甲苯苯环上的一个氢原子被-C3H7取代得到的有机物结构共有3种
B. 等质量的苯和甲苯分别完全燃烧后,生成的CO2与消耗的O2的物质的量均相同
C. 苯和甲苯均能发生取代反应和加成反应
D. 间二甲苯只有一种结构可说明苯分子中不存在碳碳单键与碳碳双键交替的结构
难度: 中等查看答案及解析
-
Li-FeS2热激活电池以固体KCl、LiCl为电解质,放电总反应为:FeS2+4Li=Fe +2Li2S,下列说法不正确的是( )
A. 负极反应式为:Li-e-=Li+ B. 正极反应式为:FeS2+4e-=Fe+2S2-
C. 电池放电时K+向正极移动 D. 可用KCl、LiCl的水溶液做电解质溶液
难度: 困难查看答案及解析
-
下列实验装置(固定装置略去)能完成相应实验目的的是( )
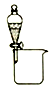
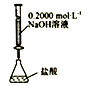
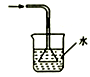
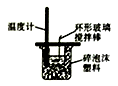
A. 分离CCl4和水 B. 酸碱中和滴定 C. 吸收HCl尾气 D. 中和热的测定
难度: 中等查看答案及解析
-
常温下,下列说法不正确的是( )
A. 将pH=4的某酸稀释10倍,测得其pH<5,则该酸为弱酸
B. 相同pH 的 CH3COONa、NaOH 和 Na2CO3三种溶液:c(NaOH)<c(Na2CO3) <c(CH3COONa)
C. 0.1 mol/L NaHA 溶液 pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D. 已知H2CO3的电离常数K1=4.4×10-7、K2=4.7×10-11,HClO的电离常数K=2.9×10-8,若向新制氯水中加入足量Na2CO3固体,则c(HClO)增大
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W、Q的原子序数依次增大,X与Q同主族,X的最外层电子数是次外层电子数的2倍,W的最外层电子数等于其电子层数,Y与Z的核外电子数之和等于X与Q的核外电子数之和,下列说法正确的是( )
A. Z、W、Q、X、Y原子半径依次减小
B. W最高价氧化物对应水化物一定能溶于Z最高价氧化物对应水化物的溶液中
C. Y与Q形成化合物在常温下一定为气态
D. Z、Q元素的单质都可以将X元素的单质从其氧化物中置换出来
难度: 困难查看答案及解析


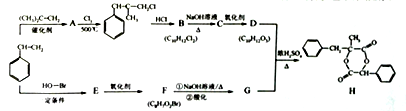
 发生加聚反应的化学方程式为________________________________;
发生加聚反应的化学方程式为________________________________;