-
将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积变大、pH变小、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积不变、pH不变、呈中性难度: 中等查看答案及解析
-
在一定体积的密闭容器中放入3L气体R和5L气体Q,在一定条件下发生反应2R(g)+5Q(g)═4X(g)+nY(g)反应完全后,容器温度不变,混合气体的压强是原来的87.5%,则化学方程式中的n值是( )
A.2
B.3
C.4
D.5难度: 中等查看答案及解析
-
在一定温度和压强下,合成氨反应达到平衡时,下列操作平衡不发生移动的是( )
A.恒温、恒压时充入氨气
B.恒温、恒容时充入氮气
C.恒温、恒容时充入氦气
D.恒温、恒压时充入氦气难度: 中等查看答案及解析
-
下列热化学方程式中△H代表燃烧热的是( )
A.CH4(g)+O2(g)=2H2O(l)+CO(g)△H
B.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H
C.S(s)+O2(g)=SO3(s)△H
D.2CO(g)+O2(g)=2CO2(g)△H难度: 中等查看答案及解析
-
反应2A(g)+B(g)⇌2C(g)△H>0.下列反应条件有利于生成C的是( )
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压难度: 中等查看答案及解析
-
可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列各关系中能说明反应已达到平衡状态的是( )
A.2υ正(H2)=3υ逆(NH3)
B.υ正(N2)=υ逆(NH3)
C.3υ正(N2)=υ正(H2)
D.υ正(N2)=3υ逆(H2)难度: 中等查看答案及解析
-
对已达化学平衡的下列反应:2X(g)+Y(g)⇌2Z(g)减小压强时,对反应产生的影响是( )
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动难度: 中等查看答案及解析
-
在真空密闭容器中盛有1mol PCl5发生反应PCl5(气)⇌PCl3(气)+Cl2(气)达平衡后,PCl5所占体积分数为a%,若在同一温度和同一容器中,最初投入的是3mol PCl5,反应达平衡,PCl5体积分数为b%,则a b关系正确的是( )
A.a大于b
B.a小于b
C.a等于b
D.无法比较难度: 中等查看答案及解析
-
用惰性电极分别电解下列物质的水溶液一段时间后,氢离子浓度不会改变的是( )
A.NaCl
B.CuSO4
C.AgNO3
D.Na2SO4难度: 中等查看答案及解析
-
可逆反应H2(g)+I2(g)⇌2HI(g)△H<0 达到平衡后,当改变外界条件如物质浓度、体系压强、温度等而发生下列项目的变化时,能作为平衡一定发生了移动的标志的是( )
A.气体的密度变小了
B.反应物和生成物浓度均变为原来的2倍
C.气体的颜色变深了
D.体系的温度发生了变化难度: 中等查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述正确的是( )
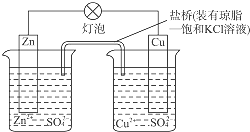
A.正极反应为:Zn-2e-═Zn2+
B.电池反应为:Zn+Cu2+═Zn2++Cu
C.在外电路中,电子从正极流向负极
D.盐桥中的K+移向ZnSO4溶液难度: 中等查看答案及解析
-
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,研读图,下列判断不正确的是( )

A.K闭合时,d电极反应式:PbSO4+2H2O-2e-═PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,I中消耗的H2SO4为0.2mol
C.K闭合时,II中SO42-向c电极迁移
D.K闭合一段时间后,II可单独作为原电池,d电极为正极难度: 中等查看答案及解析
-
在一可变容积的密闭容器中进行反应:C(s)+H2O(g)=CO(g)+H2(g),下列条件能使反应速率增大的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2,使体系的压强增大
D.保持压强不变,充入N2,使容器的体积变大难度: 中等查看答案及解析
-
甲醇燃料电池可用于笔记本电脑等,它一极通入氧气,另一极通入甲醇;电解质能传导H+.电池工作时,2CH3OH+3O2=2CO2+4H2O,下列说法正确的是( )
A.通甲醇一极为正极
B.正极电极反应式3O2+12H++12e-=6H2O
C.电池工作时电子从氧气一极流向甲醇一极
D.当转移24mole-时,消耗的甲醇2mol难度: 中等查看答案及解析
-
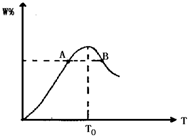
在密闭容器中进行下列反应:M(气)+N(气)⇌R(气)+2L(?)此反应符合下面图象,下列叙述正确的是( )
A.正反应放热,L是气体
B.正反应吸热,L是固体
C.正反应吸热,L是气体
D.正反应放热,L是固体或液体难度: 中等查看答案及解析
-
在密闭容器中,aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是( )
A.平衡向逆反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b难度: 中等查看答案及解析
-
将1mol SO2和1mol O2通入体积不变的密闭容器,在一定温度和催化剂下达平衡,平衡时SO3为0.3mol,若此时再加1mol SO2和1mol O2,则达新平衡时SO3的物质的量是( )
A.0.3mol
B.0.15mol
C.小于0.6mol
D.大于0.6mol难度: 中等查看答案及解析
-
常温时,将pH=4的盐酸和pH=10的氨水等体积混合后,所得溶液的pH( )
A.等于7
B.大于7
C.小于7
D.无法判断难度: 中等查看答案及解析
-
常温下,向纯水中加入氢氧化钠,使溶液的PH为10,则由氢氧化钠电离出的OH-离子浓度与水电离出的OH-离子浓度之比为( )
A.1010:1
B.108:1
C.106:1
D.1:1难度: 中等查看答案及解析
-
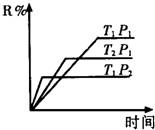
反应aM(g)+bN(g)
cP(g)+dQ(g)达到平衡时.M的体积分数y(M)与反应条件的关系如下图所示.其中:Z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )

A.同温同压同Z时,加入催化剂,平衡时Q的体积分数增加
B.同温同压时,增加Z,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同压同Z时,升高温度,平衡时Q的体积分数增加难度: 中等查看答案及解析