-
下列化学用语或叙述正确的是( )
A. -OH与OH-均是10电子粒子 B. H2O2的电子式:H+[:O: O:]2-H+
C. 在分子晶体中不一定有化学键 D. 在晶体中,有阳离子就一定有阴离子
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在物质的量均为1mol的LiH、LiD、LiT三种物质中,质子数之比为4∶5∶6
B.Ca2+、K+、Cl-、S2-四种离子的半径依次减小
C.在原子中,质量数一定大于质子数
D.一个乙烷分子中存在7对共用电子
难度: 中等查看答案及解析
-
下列反应的离子方程式的书写中,正确的是( )
A.碳酸氢钙溶液中加入足量烧碱溶液:Ca2++ HCO3—+OH—=CaCO3↓+H2O
B.向溴水中通入SO2:Br2+2H2O+SO2=4H++SO42—+2Br—
C.向水中通入Cl2:Cl2+H2O=2H++Cl—+ClO—
D.把一小块Na投入到足量的水中:Na + H2O=Na+ + OH—+ H2↑
难度: 中等查看答案及解析
-
某反应中有六种微粒:Co2O3、H2O、Cl2、H+、Cl—和Co2+,已知氧化性:Co2O3>Cl2。下列叙述不正确的是( )
A.氧化产物为Cl2
B.微粒的还原性Cl—>Co2+
C.氧化剂与还原剂的物质的量之比为1:6
D.若有3molH2O生成,则反应中有2mol电子转移
难度: 中等查看答案及解析
-
用 NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.5.6 g铁粉在0.1mol氯气中充分燃烧,转移的电子数为0.3NA
B.含0.4mol HCl的浓盐酸与足量的二氧化锰反应,产生2.24升的气体(在标况下)
C.7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA
D.在石墨的晶体结构中,共价键与碳原子个数的比值为 2:3
难度: 中等查看答案及解析
-
甲、乙、丙是三种不含相同离子的可溶性强电解质。它们所含离子如右表所示:取等质量的三种化合物配制相同体积的溶液,其溶质物质的量浓度:c(甲)>c(乙)>c(丙),则乙物质可能是( )
阳离子
NH4+、Na+、Mg2+
阴离子
OH-、NO3-、SO42-
①MgSO4 ②NaOH ③(NH4)2SO4 ④Mg(NO3)2 ⑤NH4NO3
A.①② B.③④ C .①⑤ D.③⑤
难度: 中等查看答案及解析
-
有机物甲(结构如图所示)
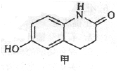 是合成西洛他唑(商品名platal)的重要中间体,也是合成抗血栓药、哮喘药、强心药等药的重要中间体。下列对它的分析合理的是( )
是合成西洛他唑(商品名platal)的重要中间体,也是合成抗血栓药、哮喘药、强心药等药的重要中间体。下列对它的分析合理的是( )A.甲分子中所有原子可能共同一平面
B.甲分子的分子式是C9H6O2N
C.甲分子遇FeCl3溶液呈现紫色
D. 1mol甲最多可以分别和1 mol NaOH、1 mol Br2反应
难度: 中等查看答案及解析
-
向含0.14 mol Na2CO3的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是( )
A.得0. 2 mol NaCl和0.08 mol NaHCO3
B.剩0.04 mol Na2CO3,得0.20 mol NaCl
C.剩0.06 mol HCl,得0.14 mol NaCl和0.14 mol NaHCO3
D.得0.06 mol NaCl和0.08 mol NaHCO3
难度: 中等查看答案及解析