-
氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。氢能具有的优点包括
①原料来源广 ②易燃烧、热值高 ③储存方便 ④制备工艺廉价易行
A. ①② B. ①③ C. ③④ D. ②④
难度: 简单查看答案及解析
-
下列属于放热反应的是( )
A. 浓硫酸的稀释 B. 铝热反应
C. 氢气还原氧化铜 D. Ba(OH)2·8H2O晶体和NH4Cl晶体反应
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是 ( )
A. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B. 已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g) ΔH2;则ΔH2>ΔH1
C. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D. 放热过程(ΔH<0)或熵增加(ΔS> 0)的过程一定是自发的
难度: 困难查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以,升高温度,反应的速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
难度: 中等查看答案及解析
-
将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)
2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A. 混合气体的密度
B. 混合气体的压强
C. 混合气体的总物质的量
D. 混合气体的平均相对分子质量
难度: 中等查看答案及解析
-
在2L的密闭容器中,发生以下反应:2A(g)+ B(g)
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
难度: 中等查看答案及解析
-
已知H+ +OH- ====H2O生成1 mol H2O放出热量57.3 kJ,下列反应中能放出57.3 kJ热量的是( )
A.1 mol稀H2SO4与足量NaOH溶液反应
B.稀盐酸与氨水反应生成1 mol H2O
C.稀盐酸与稀Ba(OH)2溶液反应生成1 mol水
D.稀NaOH与95%浓硫酸反应生成1 mol水
难度: 中等查看答案及解析
-
氢气在氧气中燃烧产生淡蓝色火焰,在反应中,破坏1mol H-H键消耗的能量为Q1kJ,破坏1mol O=O键消耗的能量为Q2kJ,形成1mol H-O键释放的能量为Q3kJ。下列关系式中正确的是( )
A. 2Q1+ Q2<4Q3 B. 2Q1+ Q2>4Q3
C. Q1+ Q2<Q3 D. Q1+ Q2=Q3
难度: 中等查看答案及解析
-
在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A.ΔH3=ΔH1-ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1+2ΔH2
难度: 中等查看答案及解析
-
一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响生成氢气的量,可向其中加入
A. KCl固体 B. 铁粉
C. K2SO4溶液 D. KNO3溶液
难度: 中等查看答案及解析
-
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) ⇌3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A. 1 mol B和3 mol C
B. 2 mol A、1mol B和1 mol He(不参加反应)
C. 1 mol B和1 mol C
D. 2 mol A、3mol B和3 mol C
难度: 中等查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
难度: 中等查看答案及解析
-
对达到平衡状态的可逆反应:A+B
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
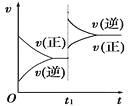
A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
难度: 困难查看答案及解析
-
已知葡萄糖的燃烧热是 -2804 kJ/mol,当它氧化生成1 g 液态水时放出的热量是
A. 26.0 kJ B. 51.9 kJ C. 155.8 kJ D. 467.3 kJ
难度: 简单查看答案及解析
-
在高温下,反应2HBr(g) ⇌ H2(g)+Br2(g)(正反应为吸热反应)达到平衡时,要使混合气体的颜色加深,且使Br2的百分含量保持不变,可采取的方法是( )
A. 减小压强 B. 增大氢气浓度 C. 升高温度 D. 缩小体积
难度: 中等查看答案及解析
-
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
难度: 困难查看答案及解析
-
铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景。实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160g固体铁红放出130kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
A. 2FeCO3 +1/2O2 =Fe2O3 +2CO2△H=-130 kJ/mol
B. 4FeCO3(s)+O2 (g) =2Fe2O3(s)+4CO2(g) △H=+260 kJ/mol
C. 4FeCO3(s)+O2 (g) =2Fe2O3(s)+4CO2(g) △H=+130 kJ/mol
D. 4FeCO3(s)+O2 (g) =2Fe2O3(s)+4CO2(g) △H=-260 kJ/mol
难度: 简单查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是ΔH1=-285.8kJ/mol、ΔH2=-1411.0kJ/mol和ΔH3=-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A. -44.2kJ/mol B. +44.2kJ/mol C. -330kJ/mol D. +330kJ/mol
难度: 中等查看答案及解析
-
一定温度下,反应2SO2(g)+O2(g) ⇌ 2SO3(g),达到平衡时: n(SO2)∶n(O2)∶n(SO3)=2∶3∶4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物质的量应是( )
A. 1.2 mol B. 0.4 mol C. 0.8 mol D. 0.6 mol
难度: 中等查看答案及解析
-
羰基硫(COS)可作为粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) ⇌ COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. CO的平衡转化率为80%
C. 通入CO后,正反应速率逐渐增大
D. 反应前H2S物质的量为7 mol
难度: 中等查看答案及解析