-
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力
而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.FeS + 2H+ = Fe2+ + H2S↑
D.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
难度: 中等查看答案及解析
-
下列反应所得溶液中一定只含有一种溶质的是
A.向稀硝酸中加入铁粉
B.向稀盐酸中滴入少量的NaAlO2溶液
C.向NaOH溶液中通入CO2气体
D.向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH) 2溶液
难度: 中等查看答案及解析
-
下列各物质中,前者是纯净物,后者是混合物的是
A.水煤气、铝热剂 B.硫酸铜晶体、漂白粉
C.盐酸、磷酸钙 D.玻璃、含Fe为70%的氧化铁
难度: 简单查看答案及解析
-
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是
①Al、Fe ②Cl2、S ③Mg、C ④H2、Cu ⑤C、Si
A.只有①③ B.只有②④ C.只有①②③④ D.①②③④⑤
难度: 简单查看答案及解析
-
下列各组离子在碱性条件下能大量共存,且在强酸性条件下能发生氧化还原反应的是
A.Ca2+、Al3+、SO42-、Cl- B.K+、Na+、SO32-、NO3-
C.Na+、K+、NO3-、SO42- D.NH4+、Na+、Cl-、CO32-
难度: 简单查看答案及解析
-
除去下列物质中少量杂质的方法正确的是
A.除去CO2中混有的HCl:用饱和碳酸钠溶液洗气
B.除去NO2中混有的NO:用水洗气
C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤
D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤
难度: 简单查看答案及解析
-
下列褪色过程不是因为氧化还原反应而褪色的是
A.SO2气体通入溴水使溴水褪色
B.氯水使滴有酚酞的NaOH溶液褪色,加入NaOH后不变红
C.将苯滴入溴水中振荡,溴水层褪色
D.将含有碘单质的淀粉溶液,加入NaOH溶液后蓝色褪去
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42- = BaSO4↓+H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:
Ca2++HCO3-+2OH- = CaCO3↓+CO32-+2H2O
C.Na2CO3溶液中通入少量CO2: CO32-+CO2+H2O = 2HCO3-
D.CH3COOH溶液与NaOH溶液反应: H++OH- = H2O
难度: 简单查看答案及解析
-
下列各组物质的无色溶液,不用其它试剂即可鉴别的是
①KOH Na2SO4 AlCl3 ②NaHCO3 NaNO3 H2SO4
③HCl NaAlO2 NaCl ④Ca(OH)2 Na2CO3 BaCl2
A.①③ B.②③ C.①④ D.①②
难度: 简单查看答案及解析
-
阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
A.25℃时,1 L pH=13的NaOH溶液中约含有6.02×1023个氢氧根离子
B.1L 1 mol·L-1的盐酸中,所含氯化氢分子数为6.02×1023
C.1 mol羟基(-OH)所含的电子数约为10×6.02×1023
D.标准状况下,测得一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于6.02×1023
难度: 简单查看答案及解析
-
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol 还原产物,就有0.6 mol 电子转移
C.稀HNO3 在反应中只作氧化剂
D.磁性氧化铁中的所有铁元素全部被氧化
难度: 简单查看答案及解析
-
由NO、H2、CO2组成的混合气体,通过足量的Na2O2充分反应后,再用电火花引燃使其充分反应,最终只得到质量分数为70%的硝酸,且无其他任何气体剩余。则原混合气体中NO、H2、CO2的体积比为
A. 2: 4:3 B.2:4:5 C.2:4:7 D.3:5:8
难度: 简单查看答案及解析
-
关于下列各装置图的叙述中,正确的是




① ② ③ ④
A.实验室用装置①制取氨气
B.装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸
C.装置③可用于制备氢氧化亚铁并观察其颜色
D.装置④是原电池,锌电极为负极,发生还原反应
难度: 简单查看答案及解析
-
有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
难度: 简单查看答案及解析
-
在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入 0.1mol铁粉,充分搅拌后铁完全反应,溶液中不存在Fe3+,同时析出0.1molAg。则下列结论中不正确的是
A.反应后溶液中Cu2+与Fe2+的物质的量之比为1:2
B.氧化性:Ag+>Cu2+>Fe3+>Zn2+
C.含Fe3+的溶液可腐蚀铜板
D.1molFe可还原2molFe3+
难度: 简单查看答案及解析
-
a g下列物质在氧气中充分燃烧后的气体(1.01×105 Pa,120℃),通过足量的过氧化钠充分反应后,过氧化钠增重b g,符合b>a 的选项有
A.HCHO B.CH3COOCH2CH3 C.HOOCCOOH D.HCOOH
难度: 简单查看答案及解析
-
室温下,0.1mol/L的氨水溶液中,下列关系式中不正确的是
A.c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+) B.c(NH3·H2O)+c(NH4+)=0.1mol/L
C.c(OH-)>c(H+) D.c(OH-)=c(NH4+)+c(H+)
难度: 简单查看答案及解析
-
往含0.2mol KOH和0.1mol Ca(OH)2的溶液中持续地通入CO2气体,当通入气体的体积为6.72L(标准状况)时立即停止,则在这一过程中,溶液中离子的物质的量n和通入CO2的体积V的关系示意图正确的是(气体的溶解和离子的水解忽略)

难度: 简单查看答案及解析

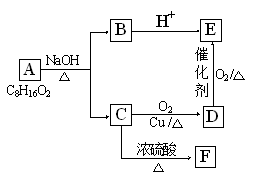
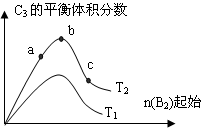 a.v(C3)=2 v (B2); b.容器内压强保持不变
a.v(C3)=2 v (B2); b.容器内压强保持不变 ①Na ②N2 ③C ④S
①Na ②N2 ③C ④S