-
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后( )
A.整个溶液变紫色
B.整溶液变为棕黄色
C.上层为无色下层为紫红色
D.下层无色上层紫红色难度: 中等查看答案及解析
-
下列关于Na2CO3的分类叙述错误的是( )
A.Na2CO3属于钠盐
B.Na2CO3俗名为纯碱,故它属于碱类
C.Na2CO3属于碳酸盐
D.Na2CO3属于含氧酸盐难度: 中等查看答案及解析
-
高锟因“有关光在光纤维中的传输以用于光学通信方面”做出了突破性成就而获得2009年诺贝尔物理学奖.光纤通讯是光作为信息的载体,让光在光导纤维中传输.制造光导纤维的基本原料是( )
A.硅
B.铁
C.石英
D.纯碱难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.工业上可用碳在高温下还原二氧化硅制取硅
B.工业上可用氯气和石灰乳为原料制造漂白粉
C.镁条不能在二氧化碳气体中燃烧
D.将盛有氢氧化铁胶体的烧杯置于暗处,用一束光照射,从垂直于光线的方向可以观察到一条光亮的通路难度: 中等查看答案及解析
-
下列有关海水综合利用的说法正确的是( )
A.从海水中提取钠单质只有物理变化发生
B.从海水制食盐主要是通过化学变化完成
C.电解氯化钠溶液可以制得钠单质和氯气
D.电解熔融的氯化镁可制备镁单质和氯气难度: 中等查看答案及解析
-
减压吸滤装置和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是( )
A.可过滤胶状沉淀
B.可过滤颗粒更小的沉淀
C.可使沉淀中的杂质减少
D.可得到较干燥的沉淀难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A.2.3g金属钠变成钠离子时失去的电子数目为0.1NA
B.在常温常压下,11.2L氧气含有的电子数为8NA
C.标准状况下,22.4L单质溴含有的原子数为2NA
D.惰性电极电解饱和食盐水若产生2g H2,则生成的氯气为2mol难度: 中等查看答案及解析
-
澄清透明溶液中能大量共存的离子组是( )
A.HCO3-、Na+、K+、H+
B.NO3-、Cu2+、Na+、OH-
C.Al3+、K+、NO3-、OH-
D.Fe3+、H+、Na+、Cl-难度: 中等查看答案及解析
-
下列仪器常用于物质分离的是( )
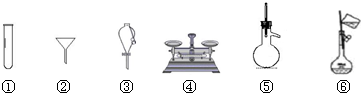
A.③⑤⑥
B.②③⑤
C.②④⑤
D.①②⑥难度: 中等查看答案及解析
-
0.5L 1mol•L-1 FeCl3溶液与0.2L 1mol•L-1 KCl溶液中的Cl-的浓度之比( )
A.1:1
B.3:1
C.15:2
D.5:2难度: 中等查看答案及解析
-
下列物质在空气中久置会发生变质,且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )
A.苛性钠溶液
B.漂白粉
C.氯水
D.生石灰难度: 中等查看答案及解析
-
35Cl是氯的一种核素,下列说法中正确的是( )
A.35Cl原子所含质子数是18
B.0.1mol的1H35Cl分子中所含中子数约为6.02×1023个
C.3.5g 35Cl2气体的体积为1.12L
D.35Cl2 的摩尔质量为70g•mol-1难度: 中等查看答案及解析
-
制备硅单质时,主要化学反应如下:
(1)SiO2+2CSi+2CO↑
(2)Si+2Cl2SiCl4
(3)SiCl4+2H2Si+4HCl
下列对上述三个反应的叙述中,不正确的是( )
A.(1)(3)为置换反应
B.(1)(2)(3)均为氧化还原反应
C.(2)为化合反应
D.三个反应的反应物中硅元素均被还原难度: 中等查看答案及解析
-
下列溶液中通入过量CO2气体,最终没有沉淀的是( )
A.Na2SiO3溶液
B.Ca(OH)2溶液
C.饱和Na2CO3溶液
D.NaAlO2溶液难度: 中等查看答案及解析
-
以下物质间的每步转化通过一步反应就能实现的是( )
A.Al→Al2O3→Al(OH)3→NaAlO2
B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.Cu→CuO→Cu(OH)2→CuSO4
D.Si→SiO2→H2SiO3→Na2SiO3难度: 中等查看答案及解析
-
反应Fe+HNO3-Fe(NO3)3+H2O+[],若铁跟起氧化作用的硝酸的物质的量之比为4:3,则方框内的物质是( )
A.NO2
B.NO
C.N2O
D.N2难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.实验室用大理石和稀盐酸制取二氧化碳:2H++CO═CO2↑+H2O
B.铁和稀盐酸反应:Fe+2H+═H2↑+Fe2+
C.向AlCl3溶液中加入过量NaOH溶液:Al3++3OH-═Al(OH)3↓
D.氢氧化钡溶液与硫酸反应:OH-+H+═H2O难度: 中等查看答案及解析
-
下列根据实验现象所得出结论中,一定正确的是( )
A.无色试液中加入AgNO3溶液产生白色沉淀,结论:试液中含Cl-
B.无色溶液焰色反应呈黄色.结论:试液是钠盐溶液
C.无色试液加入Na2CO3溶液产生白色沉淀,结论:试液中含Ca(OH)2
D.某气体能使润湿的红色石蕊试纸变蓝,结论:该气体为NH3难度: 中等查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子可能是( )
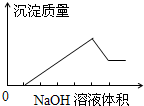
A.Mg2+、Al3+、Fe3+
B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+
D.Na+、Mg2+、Al3+难度: 中等查看答案及解析
-
除去下列括号内的杂质,所加试剂和操作均正确的是( )
选项 需除杂的物质 试剂 操作 A Fe2O3(Al2O3) NaOH溶液 过滤 B CO2(HCl) NaOH溶液 将气体通过洗气瓶 C NaCl(Na2CO3) 稀硫酸 蒸发结晶 D NH3(H2O) 浓硫酸 将气体通过洗气瓶
A.A
B.B
C.C
D.D难度: 中等查看答案及解析