-
“促进低碳经济,减少CO2的排放”是联合国《哥本哈根气候变化》会议的主题.下列行为中不符合这一主题的是( )
A.发展水电,开发新能源,如核能、太阳能、风能等,减少对化石能源的依赖
B.限制化工发展,关停化工企业,消除污染源头
C.利用工业生产产生的二氧化碳制造全降解塑料
D.推广煤的干馏、气化、液化技术,提供清洁、高效燃料和基础化工原料难度: 中等查看答案及解析
-
全氟丙烷(C3F8)是一种高效的温室气体.下列有关全氟丙烷说法不正确的是( )
A.全氟丙烷的电子式为:
B.相同压强下沸点:C3F8>C3H8
C.C3F8分子中三个碳原子不在同一直线上
D.全氟丙烷分子中既有极性键又有非极性键难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强
B.H2S加热到300℃时就分解,H2O加热到1000℃才分解,说明O非金属性比S强
C.将(NH4)2Fe(SO4)2•6H2O试样溶于稀硝酸,滴加KSCN溶液,出现血红色,说明该试样已变质
D.由ⅠA族和ⅦA族的元素形成的离子晶体,晶体的结构完全相同难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值.下列叙述正确的组合是( )
①2.3g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
②含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
③标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA.
④25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
⑤100mL 1mol•L-1 AlCl3溶液中含阳离子数大于0.1NA
⑥含有NA个NO2、N2O4分子的混合气体,降低温度,混合气体的分子总数小于NA.
A.①②⑥
B.②④⑥
C.③⑤⑥
D.①⑤⑥难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
A.铵态氮肥不能与草木灰混合施用
B.工业上用石灰乳对煤燃烧形成的烟气进行脱硫,最终能制得石膏
C.镁合金的硬度和强度均高于纯镁,工业上采用电解MgCl2饱和溶液制得镁
D.MgO 的熔点很高,可用于制作耐高温材料,但工业上不用MgO制镁难度: 中等查看答案及解析
-
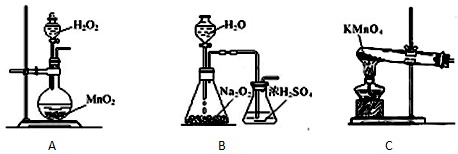
下列有关实验操作或对实验的描述正确的是( )
A.为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体
B.用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出
C.实验室用如图所示装置可制取乙烯并验证乙烯的某些化学性质
D.鉴别己烯中是否混有少量甲苯,先加足量的酸性高锰酸钾溶液,然后再加入溴水难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.向CuSO4溶液中滴加过量的氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+
B.Na2S溶液吸收足量SO2:S2-+2SO2+2H2O=2HSO3-+H2S↑
C.向2 mol•L-1Fe(NO3)2溶液中滴加少量氢碘酸:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
D.用惰性电极电解等物质的量浓度的FeBr2和CuCl2混合溶液时最初发生:Cu2++2Br-Cu+Br2
难度: 中等查看答案及解析
-
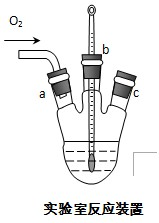
下列实验设计能够成功的是( )
实验目的 实验步骤及现象 A 检验亚硫酸钠试样是否变质 试样 白色沉淀
沉淀不溶
B 检验某卤代烃是否是氯代烃 试样 冷却
出现白色沉淀
C 证明酸性条件下H2O2氧化性比I2强 NaI溶液 溶液变蓝色
D 证明Ksp(BaSO4)>Ksp(BaCO3) BaSO4悬浊液 过滤、洗涤得固体
气体
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.在浓度均为0.1 mol•L-1Na2CO3、NaHCO3、、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c3>c2>c1
难度: 中等查看答案及解析
-
将几滴KSCN(SCN-是“类卤离子”)溶液加入到含有Fe3+的酸性溶液中,溶液变成红色.将该红色溶液分为两份:①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去.下列推测肯定不正确的是( )
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪去的原因是SO2将Fe3+还原为Fe2+
C.②中红色褪去的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化为(SCN)2难度: 中等查看答案及解析
-
利用图所示的有机物X可生产S-诱抗素Y.下列说法正确的是( )

A.X结构中有2个手性碳原子
B.X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐
C.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D.1 molX与足量NaOH溶液反应,最多消耗5 mol NaOH,1 molY最多能加成4 molH2难度: 中等查看答案及解析
-
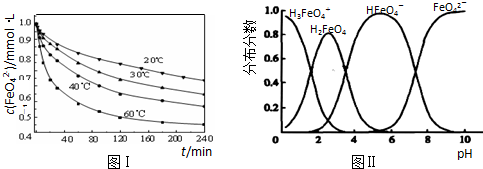
化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )

A.根据图①可判断可逆反应“A2(g)+3B2(g)⇌2AB3(g)”的△H>0
B.图②表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右难度: 中等查看答案及解析